Acido clorico
| Acido clorico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido triossoclorico(V) | |
| Nomi alternativi | |
| acido clorico(V) | |
| Caratteristiche generali | |
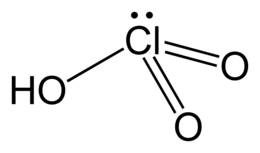
| Formula bruta o molecolare | HClO3 |
| Peso formula (u) | 84,45914 |
| Aspetto | soluzione acquosa incolore |
| Numero CAS | |
| Numero EINECS | 232-233-0 |
| PubChem | 19654 |
| DrugBank | DBDB14150 |
| SMILES | OCl(=O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/l, in c.s.) | ca. 1000 g/L |
| Costante di dissociazione acida (pKa) a 293,15 K | -2,7 |
| Solubilità in acqua | 400 g/L |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 9-20/22-35 |
| Frasi S | 2-13-16-27 |
L'acido clorico è un ossiacido del cloro pentavalente, Cl(V), avente formula HClO3. Non è noto allo stato puro, ma solo nelle sue soluzioni acquose, dove si comporta da acido forte (pKa = -2,7).[1] Ha spiccate proprietà ossidanti, che condivide con i suoi sali, i clorati [E°(ClO3− / Cl−) = 1,450 V (pH = 0)].[2]
Sintesi
[modifica | modifica wikitesto]Viene prodotto trattando clorati con un acido forte come l'acido solforico; usando clorati di cationi che con il solfato dà sali poco solubili si ottengono soluzioni contenenti solo acido clorico. Con il clorato di bario, ad esempio, si ha precipitazione di BaSO4, che viene filtrato e in soluzione rimane HClO3:[3]
Un altro metodo consiste nel riscaldamento dell'acido ipocloroso, che in tal modo subisce una disproporzione, per dare acido cloridrico e acido clorico:
Caratteristiche
[modifica | modifica wikitesto]È stabile in soluzioni acquose fino al 30%. A pressione ridotta, si può concentrare sopra il 40% per evaporazione dell'acqua. Sopra queste concentrazioni, e per riscaldamento, l'acido clorico si decompone, ancora con disproporzioni, dando acido perclorico e diversi altri prodotti:
Note
[modifica | modifica wikitesto]- ^ Egon Wiberg, Nils Wiberg e A. F. Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 520, ISBN 978-3-11-026932-1, OCLC 970042787. URL consultato il 19 settembre 2024.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 513, ISBN 978-3-11-026932-1.
- ^ Therald Moeller, John Bailar, Jr. e Jakob Kleinberg, Chemistry with inorganic qualitative analysis, Acad. Pr, 1980, p. 630, ISBN 978-0-12-503350-3.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido clorico
Wikimedia Commons contiene immagini o altri file su acido clorico




