Kadmij
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kadmij u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Kadmij, Cd, 48 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Prelazni metali | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 12, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | srebreno sivi metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 3 · 10−5[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 112,414(4)[2][3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 155 (161) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 144 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | 158 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Kr] 4d10 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 18, 18, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izlazni rad | 4,2[4] eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 867,8 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 1631,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova skala tvrdoće | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | heksagonalna | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 8650[5] kg/m3 pri 298,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | dijamagnetičan ( = −1,9 · 10−5)[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 594,22 K (321,07 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 1038[7] K (765 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | 13,00 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 100[7] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 6,2[8] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 14,8 Pa pri 597 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 2310 m/s pri 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična električna provodljivost | 14,3 · 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 97 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksid | CdO | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | −0,403 V (Cd2+ + 2e− → Cd) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 1,69 (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oznake upozorenja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: 17-26-45-48/23/25-50/53-62-63-68 S: 7/8-43-45-53-60-61 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Kadmij je hemijski element sa simbolom Cd i atomskim brojem 48. To je mehki, plavkasto-bijeli metal koji je hemijski sličan sa druga dva stabilna metala 12. grupe, cinkom i živom. Kao i cink, kadmij preferira oksidacijsko stanje +2 u većini svojih spojeva, a kao živa ima vrlo nisku tačku topljenja u usporedbi sa prelaznim metalima. Kadmij i njegovi kongeneri nisu se oduvijek smatrali prelaznim metalima, između ostalog jer nemaju djelimično popunjenu d ili f elektronsku ljusku u elementarnom ili uobičajenim oksidacijskim stanjima. Prosječna koncentracija kadmija u Zemljinoj kori kreće se između 0,1 i 0,5 ppm (dijelova na milion). Kadmij su otkrila dvojica njemačkih hemičara Stromeyer i Hermann, kao nečistoću u cink-karbonatu.
Kadmij se javlja i kao sporedna komponenta u većini cinkovih ruda te je kao takav nusproizvod u proizvodnji cinka. Dugo vremena se koristio kao pigment i za zaštitno prekrivanje čelika od korozije, a spojevi kadmija su se koristili za stabilizaciju plastike. Korištenje kadmija je općenito smanjeno zbog njegove otrovnosti (on je decidno naveden u Evropskoj listi ograničenja opasnih supstanci (ROHS)[9] te se iz tih razloga masovno nikl-kadmijske baterije zamjenjuju s baterijama na bazi nikl-metal hidrida i litij-ionskim baterijama. Jedna od njegovih malobrojnih aplikacija je u vidu kadmij-telurida u solarnim pločama. Iako kadmij nema poznatnih bioloških uloga u višim organizmima, neke karbonične anhidraze zavisne od kadmija pronađene su kod morskih silikatnih algi.
Historija
[uredi | uredi izvor]
Kadmij (latinski: cadmia, grč. καδμεία u značenju "kalamin", odnosno mješavina minerala koji između ostalog sadrže kadmij, a koja je dobila ime po liku iz grčke mitologije Κάδμος, Kadmosu, osnivaču grada Tebe) su istovremeno otkrili 1817. njemački hemičari Friedrich Stromeyer[10] i Karl Samuel Leberecht Hermann, kao nečistoću u cink-karbonatu.[9]
Stromeyer je novi element pronašao u vidu nečistoća u kalaminu (cink-karbonat), a narednih 100 godina, Njemačka je ostala jedini važniji proizvođač ovog metala. Metal je dobio ime po latinskoj riječi za kalamin, jer je pronađen u ovom cinkovom spoju. Stromeyer je zapazio da neki nepotpuno čisti uzorci kalamina mijenjaju boju pri zagrijavanju dok čisti kalamin zadržava prvobitnu boju. Nastavio je proučavati ove rezultate te je najzad žarenjem i redukcijom kadmij-sulfida uspio izdvojiti metalni kadmij. Mogućnost korištenja kadmija kao žutog pigmenta pronađena je 1840ih ali je tadašnji nedostatak kadmija ograničio njegovu upotrebu u ove svrhe.[11][12][13]
Iako kadmij i njegovi spojevi mogu biti otrovni u određenim oblicima i koncentracijama, Britanski farmacijski kodeks iz 1907. godine navodi da se kadmij-jodid koristio kao sredstvo za liječenje "natečenih zglobova, oteklina vratnih žlijezda (škorfule) i promrzlina".[14] Iste godine, 1907, Međunarodna astronomska unija definirala je međunarodnu jedinicu ångstrom u aspektu crvenih spektralnih linija kadmija (jedinična valna dužina = 6438,46963 Å).[15][16] Takvu definiciju usvojila je i Sedma generalna konferencija o utezima i mjerama 1927. godine. Definicije ångstroma i metra promijenjene su 1960. kada su definirane prema plemenitom gasu kriptonu.[17]
Nakon što je počela proizvodnja kadmija u industrijskom obimu 1930ih i 1940ih, jedna od najznačajnijih aplikacija kadmija bilo je prekrivanje čelika i željeza radi prevencije od korozije. Godine 1944. 62% kadmija potrošeno u Sjedinjenim Američkim Državama bilo je upravo u ove svrhe, dok je 1956. godine taj udio opao na 59%.[9][18] Iste godine, 24% kadmija potrošenog unutar SAD bilo je za proizvodnju crvenog, naranđastog i žutog pigmenta zasnovanog na sulfidima i selenidima kadmija.[18] Stabilizirajući efekt hemikalija koje sadrže kadmij poput karboksilata kadmij-laurata i kadmij-stearata na PVC doveo je do povećanja upotrebe tih spojeva 1970ih i 1980ih. Upotreba kadmija u aplikacijama poput pigmenata, stabilizatora, legura i prekrivanja drugih metala smanjena je zbog strožijih ekoloških i zdravstvenih regulativa 1980ih i 1990ih. Godine 2006. samo 7% ukupne potrošnje kadmija iskorišteno je za pokrivanje metala a 10% kao pigmenti.[9] Smanjenje potrošnje u drugim aplikacijama apsorbovano je rastućom potražnjom za kadmijem u proizvodnji nikl-kadmijskih baterija, na koje je 2006. otpadalo 81% ukupne potrošnje kadmija u SAD.[19]
Osobine
[uredi | uredi izvor]Fizičke
[uredi | uredi izvor]
Kadmij je mehki, kovni, duktilni, plavkasto-bijeli dvovalentni metal. U mnogim aspektima je sličan cinku ali formira kompleksne spojeve.[20] Za razliku od mnogih drugih metala, kadmij je otporan na koroziju, pa se zbog toga koristi kao zaštitni sloj kojim se pokrivaju drugi metali. U većim komadima, kadmij nije rastvorljiv u vodi i nije zapaljiv; međutim u obliku praha može se zapaliti te ispuštati vrlo otrovne dimove.[21]
Hemijske
[uredi | uredi izvor]Iako kadmij obično ima oksidacijsko stanje +2, on također postoji i u stanju +1. Kadmij i njegovi kongeneri nisu oduvijek smatrani za prelazne metale, u smislu da nemaju djelimično popunjene d i f elektronske ljuske u svom elementarnom ili uobičajenim oksidacijskim stanjima.[22] Kada sagorijeva u prisustvu zraka, gradi smeđi amorfni kadmij-oksid (CdO); kristalni oblik ovog spoja je tamno crven jer zagrijavanjem mijenja boju, slično cink-oksidu. Hlorovodična, sumporna i dušična kiselina rastvaraju kadmij dajući odgovarajući hlorid (CdCl2), sulfat (CdSO4) ili nitrat (Cd(NO3)2). Oksidacijsko stanje +1 se može postići rastvaranjem kadmija u mješavini kadmij-hlorida i aluminij-hlorida, kada nastaju kationi Cd22+, koji su slični kationu Hg22+ u živa(I)-hloridu.[20]
- Cd + CdCl2 + 2 AlCl3 → Cd2(AlCl4)2
Određena je i struktura mnogih kompleksa kadmija sa nukleobazama, aminokiselinama i vitaminima.[23]
Izotopi
[uredi | uredi izvor]Kadmij koji se nalazi u prirodi sastoji se iz osam izotopa. Dva od njih su prirodno radioaktivni, a za tri se sumnja da se raspadaju ali ta pretpostavka nije eksperimentalno potvrđena. Dva prirodno radioaktivna izotopa su 113Cd (raspada se beta raspadom, vrijeme poluraspada 7,7 × 1015 god.) i 116Cd (dvostruki beta raspad s dva neutrina, vrijeme poluraspada 2,9 × 1019 godina). Druga tri su 106Cd, 108Cd (oba se raspadaju dvostrukim elektronskim zahvatom) i 114Cd (dvostruki beta raspad); ali su za njihova vremena poluraspada postavljene samo donje granice. Najmanje tri izotopa, 110Cd, 111Cd i 112Cd su stabilna. Među izotopima koji se ne nalaze u prirodi, najduže živući su 109Cd s vremenom poluraspada od 462,2 dana, te 115Cd sa vremenom poluraspada od 53,46 sati. Svi ostali radioaktivni izotopi imaju vremena poluraspada kraća od 2,5 sata, a većina od njih i kraća od 5 minuta. Za kadmij je poznato osam nuklearnih izomera, među kojima su najstabilniji 113mCd (t1/2 = 14,1 godina), 115mCd (t1/2 = 44,6 dana) i 117mCd (t1/2 = 3,36 sati).[24]
Poznati izotopi kadmija imaju raspon atomskih masa od 94,95 u (95Cd) do 131,946 u (132Cd). Za izotope lakše od 112 u, osnovni način raspada je elektronski zahvat a dominantni proizvod raspada je element 47 (srebro). Teži izotopi raspadaju se uglavnom emisijom beta-zraka dajući element 49 (indij).[24]
Jedan izotop kadmija, 113Cd, apsorbira neutrone s veoma velikom vjerovatnoćom ako oni imaju energiju ispod kadmijskog praga a u suprotnom ih emitira. Kadmijski prag nalazi se na oko 0,5 eV. Neutroni sa energijom ispod granice smatraju se sporim neutronima, što ih razdvaja od srednjih i brzih neutrona.[25] Kadmij nastaje dugim s-procesom u zvijezdama srednjih masa, čije se mase kreću od 0,6 do 10 masa Sunca. Taj proces može trajati i nekoliko hiljada godina. Da bi se odvijao, njemu je potreban atom srebra koji hvata neutron te se zatim raspada beta-raspadom.[26]
Rasprostranjenost
[uredi | uredi izvor]
Kadmij čini oko 0,1 ppm (dijelova na milion) u Zemljinoj kori. Ako se uporedi s mnogo rasprostranjenijim cinkom (kojeg ima 65 ppm), kadmij je veoma rijedak metal.[27]
Nisu poznati značajni depoziti ruda koje sadrže kadmij. Jedini mineral kadmija od većeg značaja je greenockit (CdS), gotovo uvijek je povezan sa sfaleritom (ZnS). Tu povezanost prouzrokuje geohemijska sličnost cinka i kadmija što usporava i onemogućava geološku separaciju. Kao posljedica toga, kadmij se uglavnom proizvodi kao nusproizvod iz rudarenja, topljenja i rafiniranja sulfidnih ruda cinka, te u znatno manjem obimu, olova i bakra. Male količine kadmija, od oko 10% potrošnje, proizvodi se iz sekundarnih izvora, pretežno iz praha nastalog recikliranjem željeznih i čeličnih otpadaka. Proizvodnja kadmija u SAD počela je 1907.[13] ali tek nakon Prvog svjetskog rata kadmij je ušao u znatno širu upotrebu.[28][29] Jedino mjesto gdje se može pronaći metalni kadmij je bazen rijeke Viljuj u Sibiru.[30]
Stijene i rude koje se kopaju za proizvodnju fosfatnih đubriva sadrže različite količine kadmija, što dovodi da koncentracija ovog metala naraste i do 300 mg u 1 kg proizvedenih fosfatnih đubriva, te dalje do visokog udjela kadmija u poljoprivrednom zemljištu.[31][32] Ugalj također može sadržavati značajne količine kadmija, što pretežno završava u dimnoj prašini.[33]
Dobijanje
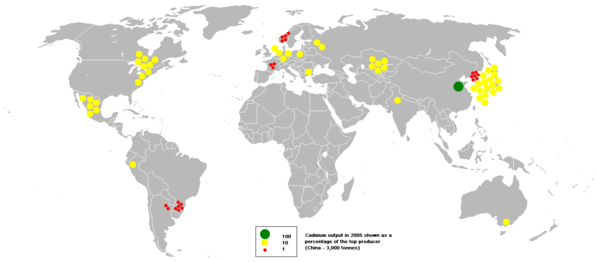
[uredi | uredi izvor]Prema izvještaju Britanskog geološkog zavoda, u 2001. godini najveći svjetski proizvođač kadmija bila je Kina, proizvodeći gotovo šestinu svjetske proizvodnje, a slijedili su je Južna Koreja i Japan.[34]
Kadmij je uobičajena nečistoća u rudama cinka, a najčešće se i izdvaja tokom proizvodnje cinka. Neke cinkove rude koje se koncentriraju iz sulfidnih ruda cinka sadrže i do 1,4% kadmija.[35] Tokom 1970ih, proizvodnja kadmija bila je oko 3 kg po toni cinka.[35] Cinkove sulfidne rude se žare u prisustvu kisika, te tako cinkovi sulfidi prelaze u okside. Metalni cink se proizvodi bilo topljenje oksida sa ugljikom ili putem elektrolize u sumpornoj kiselini. Kadmij se izdvaja iz metalnog cinka putem vakuumske destilacije, ako se cink topi, ili se kadmij-sulfat istaloži iz elektrolitičkog rastvora.[29][36]
-
Trend svjetske proizvodnje
-
Proizvodnja kadmija 2005. godine
Upotreba
[uredi | uredi izvor]Zbog velike otrovnosti kadmija, njegov značaj stalno opada. Od decembra 2011. Evropska unija je zabranila njegovu upotrebu u nakitu, za legiranje pri mehkom lemljenju te u sastavu PVC-a.[37] Kadmij se koristi odnosno koristio se, između ostalog:
- kao zaštita protiv korozije za željezne alate i predmete (kadmiranje)
- za nikl-kadmijske akumulatore i baterije
- za žute do tamno crvene pigmente izrađene od kadmij-sulfida i kadmij-selenida. Ti pigmenti ulazili su u sastav lakova i umjetnih materijala. U međuvremenu, takvi materijali su zamijenjeni modernijima, a u praksi su od sve manjeg značaja, zbog povećanje svijesti o njihovim opasnostima po zdravlje, naročito pri sagorijevanju.
- kao metal za legiranje u legurama koje imaju nisku tačku topljenja, naprimjer takozvani lager-metal ili Woodova legura
- ranije kao sredstvo za povećanje trenja u kočionim pločicama (paknama)
- kao sastojak sredstava za lemljenje, također i za tvrdo lemljenje
- za proizvodnju poluprovodnika
- kadmij-oksid kao sredstvo za osvjetljavanja u crno-bijelim televizorskim katodnim cijevima kao i dodatak u plavom i zelenom fosforu kod cijevi u boji
- kao izvor energetski bogatih gama-zraka (oko 7 MeV) iz toplotnih neutrona za kasnije dobijanje pozitrona.
- kadmij-sulfid koristio se za mjerenje osvjetljenja, jer se njegova spektralna osjetljivost podudara sa ljudskim okom
- kadmij-telurid se koristio kao senzor kamera osjetljivih na infracrveno svijetlo.
- za proizvodnju električne energije u solarnim panelima gdje se u tankom sloju nanosi u obliku telurida ili sulfida.
Biološki značaj
[uredi | uredi izvor]Do danas nije poznata niti jedna korisna uloga kadmija u višim organizmima,[38] iako su pronađene neke karbonične anhidraze zavisne od kadmija u nekim morskim dijatomejama.[39] Silikatne alge (dijatomeje, kremenjaste alge) žive u okolini s vrlo niskom koncentracijom cinka pa umjesto njega kadmij vrši funkcije koje bi obično vršio cink kod drugih anhidraza. Ovo otkriće načinjeno je korištenjem metode fluorescentne spektroskopije apsorpcijom x-zraka (XAFS).[39][40]
Otkriveno je da se najviša koncentracija kadmija apsorbira u ljudskim bubrezima, a čovjek tokom djetinjstva i odraslog doba udahne i do 30 mg kadmija.[41] Kadmij se može upotrijebiti za blokiranje kanala kalcija u neuronima pilića.[42] Istražene su analitičke metode za otkrivanje kadmija u biološkim uzorcima.[43]
Regulacije
[uredi | uredi izvor]Zbog štetnih efekata na ljudsko zdravlje i okolinu, korištenje i proizvodnja kadmija u Evropi je ograničena i regulirana takozvanom "REACH" regulacijom.[44] Panel Evropske agencije za sigurnost hrane (EFSA) o kontaminantima u hranidbenom lancu postavio je ograničenje od 2,5 μg/ po kg tjelesne mase kao tolerantni sedmični unos kadmija u ljudski organizam.[45] U usporedbi, zajednička komisija FAO/WHO o prehrambenim aditivima postavila je ograničenje od 7 μg po kg kao privremeni tolerantni sedmični nivo unosa kadmija.[46]
Američka federalna agencija za zaštitu na radu i zdravlje (OSHA) postavila je dopuštenu granicu izlaganja (PEL) za kadmij kao vremenski ponderisani prosjek od 0,005 ppm. Nacionalni institut za zaštitu na radu i zdravlje SAD (NIOSH) nije postavio preporučenu granicu izlaganju (REL) te je naveo kadmij kao poznati karcinogen za ljude. Nivo neposredne opasnosti za život i zdravlje ljudi (IDLH) za kadmij iznosi 9 mg/m3.
Reference
[uredi | uredi izvor]- ^ Harry H. Binder (1999). Lexikon der chemischen Elemente. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.
- ^ CIAAW, Standard Atomic Weights Revised 2013
- ^ "IUPAC, Standard Atomic Weights Revised v2". Arhivirano s originala, 8. 1. 2016. Pristupljeno 12. 10. 2015.
- ^ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing (2005). "vol. 6 "Festkörper"". Bergmann-Schaefer Lehrbuch der Experimentalphysik (2 izd.). Walter de Gruyter. str. 361. ISBN 3-11-017485-5.CS1 održavanje: više imena: authors list (link)
- ^ N. N. Greenwood, A. Earnshaw (1988). Chemie der Elemente (1 izd.). str. 1545. ISBN 3-527-26169-9.
- ^ Weast, Robert C. (gl.ur.) (1990). CRC Handbook of Chemistry and Physics (90 izd.). Boca Raton: CRC (Chemical Rubber Publishing Company). str. 142-147. ISBN 0-8493-0470-9.
- ^ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang (2011). "Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks". Journal of Chemical & Engineering Data. 56: 328–337. doi:10.1021/je1011086.CS1 održavanje: više imena: authors list (link)
- ^ K.-H. Schulte-Schrepping, M. Piscator: Cadmium and Cadmium Compounds u: Ullmann's Encyclopedia of Industrial Chemistry, 2005 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a04_499.
- ^ a b c d Morrow H. (2010). "Cadmium and Cadmium Alloys". Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. str. 1–36. doi:10.1002/0471238961.0301041303011818.a01.pub3. ISBN 978-0-471-23896-6.
- ^ Hermann C. S. (1818). "Noch ein schreiben über das neue Metall". Annalen der Physik. 59 (5): 113. Bibcode:1818AnP....59..113H. doi:10.1002/andp.18180590511.
- ^ Waterston W.; Burton J. H (1844). Cyclopædia of commerce, mercantile law, finance, commercial geography and navigation. H. G. Bohn. str. 122.CS1 održavanje: više imena: authors list (link)
- ^ Rowbotham T.; Rowbotham T. L. (1850). The Art of Landscape Painting in Water Colours. "Windsor and Newton". str. 10.CS1 održavanje: više imena: authors list (link)
- ^ a b Ayres R. U.; Ayres L.; Råde I. (2003). The Life Cycle of Copper, Its Co-Products and Byproducts. Springer. str. 135–141. ISBN 978-1-4020-1552-6.CS1 održavanje: više imena: authors list (link)
- ^ Dunglison R. (1866). Medical Lexicon: A Dictionary of Medical Science. Henry C. Lea. str. 159.
- ^ "International Angstrom". Science Dictionary. 14. 9. 2013. Arhivirano s originala, 18. 11. 2018. Pristupljeno 17. 10. 2015.
- ^ "angstrom or ångström". Sizes.com. 28. 10. 2010. Arhivirano s originala, 9. 7. 2023. Pristupljeno 24. 9. 2014.
- ^ Burdun G. D. (1958). "On the new determination of the meter" (PDF). Measurement Techniques. 1 (3): 259–264. doi:10.1007/BF00974680.[mrtav link]
- ^ a b Lansche A. M. (1956). "Cadmium". Minerals Yearbook, Volume I: Metals and Minerals (Except Fuels). Američki geološki zavod. Pristupljeno 21. 4. 2008.
- ^ "USGS Mineral Information: Cadmium". Američki geološki zavod. Pristupljeno 8. 8. 2009.
- ^ a b Holleman A. F.; Wiberg E; Wiberg Nils (1985). "Cadmium". Lehrbuch der Anorganischen Chemie, 91–100 (jezik: njemački). Walter de Gruyter. str. 1056–1057. ISBN 978-3-11-007511-3.CS1 održavanje: više imena: authors list (link)
- ^ "Case Studies in Environmental Medicine (CSEM) Cadmium". Agency for Toxic Substances and Disease Registry. Arhivirano s originala, 6. 6. 2011. Pristupljeno 12. 10. 2015.
- ^ Cotton F. A. (1999). "Survey of Transition-Metal Chemistry". Advanced Inorganic Chemistry (6. izd.). John Wiley and Sons. str. 633. ISBN 0-471-19957-5.
- ^ Carballo Rosa; Castiñeras Alfonso; Domínguez-Martin Alicia; et al. (2013). "pogl. 7. Solid state structures of cadmium complexes with relevance to biological systems". Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. 11. Springer. str. 145–189. doi:10.1007/978-94-007-5179-8_7. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ a b Audi G.; Bersillon O.; Blachot J.; Wapstra A.H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A. 729 (1): 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.CS1 održavanje: više imena: authors list (link)
- ^ Knoll G. F. (2000). Radiation Detection and Measurement. John Wiley & Sons. str. 505. ISBN 978-0-471-07338-3.
- ^ Padmanabhan T. (2001). "Stellar Nucleosynthesis". Theoretical Astrophysics, Volume II: Stars and Stellar Systems. Cambridge University Press. str. 230–236. ISBN 978-0-521-56631-5.
- ^ Wedepohl K. H. (1995). "The composition of the continental crust". Geochimica et Cosmochimica Acta. 59 (7): 1217–1232. Bibcode:1995GeCoA..59.1217W. doi:10.1016/0016-7037(95)00038-2.
- ^ Plachy J. (1998). "Annual Average Cadmium Price" (PDF). U.S. Geological Survey. str. 17–19. Pristupljeno 16. 6. 2010.
- ^ a b Fthenakis V. M. (2004). "Life cycle impact analysis of cadmium in CdTe PV production". Renewable and Sustainable Energy Reviews. 8 (4): 303. doi:10.1016/j.rser.2003.12.001.
- ^ Fleischer M; Cabri L. J.; et al. (1980). "New Mineral Names" (PDF). American Mineralogist. 65: 1065–1070. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ Grant C. A.; Sheppard S. C. (2008). "Fertilizer impacts on cadmium availability in agricultural soils and crops". Human and Ecological Risk Assessment. 14 (2): 210–228. doi:10.1080/10807030801934895.CS1 održavanje: više imena: authors list (link)
- ^ Jiao Y.; Grant C. A.; Bailey L. D. (2004). "Effects of phosphorus and zinc fertilizer on cadmium uptake and distribution in flax and durum wheat". Journal of the Science of Food and Agriculture. 84 (8): 777–785. doi:10.1002/jsfa.1648.CS1 održavanje: više imena: authors list (link)
- ^ Bettinelli M.; Baroni U.; Pastorelli N. (1988). "Determination of arsenic, cadmium, lead, antimony, selenium and thallium in coal fly ash using the stabilised temperature platform furnace and Zeeman-effect background correction". Journal of Analytical Atomic Spectrometry. 3 (7): 1005–1011. doi:10.1039/JA9880301005.CS1 održavanje: više imena: authors list (link)
- ^ Hetherington L. E.; et al. (2008). "Production of Cadmium". World Mineral Production 2002–06 (PDF). Britanski geološki zavod. str. 15. Arhivirano s originala 8. 11. 2012. Pristupljeno 15. 4. 2012. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: bot: nepoznat status originalnog URL-a (link) - ^ a b Golberg D. C.; et al. (1969). Trends in Usage of Cadmium: Report. US NRC/NAS/NAE. str. 1–3. Eksplicitna upotreba et al. u:
|author=(pomoć) - ^ Scoullos M. J. (2001). Mercury, Cadmium, Lead: Handbook for Sustainable Heavy Metals Policy and Regulation. Springer. str. 104–116. ISBN 978-1-4020-0224-3.
- ^ "REACH: EU verbietet Cadmium in Schmuck, in Legierungen zum Löten und in PVC". Pristupljeno 17. 11. 2011.
- ^ Hogan, C. Michael (2010): Heavy metal. Encyclopedia of Earth. National Council for Science and the Environment. E. Monosson i C. Cleveland (ur.). Washington DC.
- ^ a b Todd W. Lane; Saito Mak A.; George Graham N.; et al. (2005). "A cadmium enzyme from a marine diatom" (PDF). Nature. 435 (42): 42. Bibcode:2005Natur.435...42L. doi:10.1038/435042a. PMID 15875011. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ Todd W. Lane; Morel F. M. (2000). "A biological function for cadmium in marine diatoms". Proc. Natl. Acad. Sci. 97 (9): 4627–4631. Bibcode:2000PNAS...97.4627L. doi:10.1073/pnas.090091397. PMC 18283. PMID 10781068.CS1 održavanje: više imena: authors list (link)[mrtav link]
- ^ Perry HM Jr.; Thind GS; Perry EF (1976). "The biology of cadmium". The Medical clinics of North America. 60 (4): 759–69. PMID 775217.CS1 održavanje: više imena: authors list (link)
- ^ D. Swandulla; Armstrong C. M. (1989). "Calcium channel block by cadmium in chicken sensory neurons" (PDF). Proc. Natl. Acad. Sci. 86 (5): 1736–1740. Bibcode:1989PNAS...86.1736S. doi:10.1073/pnas.86.5.1736. PMC 286776. PMID 2537985. Arhivirano s originala (PDF), 22. 2. 2021. Pristupljeno 17. 10. 2015.CS1 održavanje: više imena: authors list (link)
- ^ Klotz Katrin; Weistenhöfer Wobbeke; Drexler Hans; et al. (2013). "Chapter 4. Determination of Cadmium in Biological Samples". Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. 11. Springer. str. 85–98. doi:10.1007/978-94-007-5179-8_4. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) - ^ EUR-Lex. Eur-lex.europa.eu (18. april 2011), pristupljeno 5. juna 2011.
- ^ Cadmium dietary exposure in the European population, pristupljeno 19. oktobra 2015, doi:10.2903/j.efsa.2012.2551
- ^ Summary of Evaluations Performed by the Joint FAO/WHO Expert Committee on Food Additives, pristupljeno 19. oktobra 2015.