Olovo
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olovo u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Olovo, Pb, 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Metali | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 14, 6, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | plavkasto bijeli | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 1,8 · 10-3[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 207,2 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 180 (154) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Xe] 4f145d106s26p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 18, 32, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 715,6 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 1450,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. energija ionizacije | 3081,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. energija ionizacije | 4083 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova skala tvrdoće | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | kubična plošno centrirana | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 11342[2] kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | dijamagnetičan ( = −1,6 · 10−5)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 600,61 K (327,43 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 2017[4] K (1744 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | 18,26 · 10-6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 177[4] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 4,77 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 4,21 · 10-7 Pa pri 600 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 1260 m/s pri 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 131[5] J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična električna provodljivost | 4,76 · 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 35 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksid | Pb3O4 (amfoteran) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | -0,1251 V (Pb2+ + 2e- → Pb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 2,33[6] (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oznake upozorenja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: 20/22-33-50/53-61-62 S: 53-45-60-61 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Olovo je hemijski element sa simbolom Pb (latinski: plumbum) i atomskim brojem 82. Ono je mehki, otrovni, teški metal. U periodnom sistemu stoji u 4. glavnoj grupi, odnosno 14. grupi po IUPACu (ugljikova grupa) te u 6. periodi. Olovo se lahko obrađuje i ima nisku tačku topljenja u odnosu na mnoge druge metale.
Izotopi olova 206Pb, 207Pb i 208Pb su najteži poznati stabilni atom, pa je olovo i najteži stabilni element periodnog sistema. Njegova stabilnost se može objasniti magičnim brojem protona 82. Kod izotopa 208Pb prisutan je takozvani dvostruki magični broj u jezgri. Izotopi olova su krajnji proizvodi tri od četiri prirodna niza raspada radioaktivnih elemenata. Na taj način nastalo je relativno mnogo olovo, zbog čega se u Zemljinoj kori nalazi relativno mnogo olova u odnosu na druge teške metale (živu, zlato i dr.).
Historija
[uredi | uredi izvor]

U ranom bronzanom dobu, pored olova, za izradu bronze koristio se antimon i arsen, sve dok se nije raširila upotreba kalaja. Babilonci su poznavali olovo i od njega izrađivali vaze. Asirci su za svoje potrebe morali uvoziti olovo (abāru). Asirski kralj Tiglat-pileser I dobijao je olovo kao danak iz osvojene Melide (današnja Malatya).[7] Rimljani su metal koristili kao materijal za posude, kao municiju za praćke, za plombe (otud i latinsko ime) i za vodovodne cijevi.
Već rimski autor Vitruvije je smatrao upotrebu olova za vodovodne cijeli štetnom po zdravlje, preporučivao je, koliko je god moguće, korištenje glinenih cijevi.[8] Međutim, i pored toga, olovne vodovodne cijevi bile su u upotrebi sve do 1970tih godina. Engleska riječ plumber (vodoinstalater) također asocira na ovaj vid upotrebe olova. Iz današnje perspektive vrlo zabrinjavajuće djeluje podatak da se olovo dodavalo vinu kao sredstvo za zaslađivanje (takozvani olovni šećer, odnosno olovo(II)-acetat). U Vestfaliji, Rimljani su kopali olovo sve do svog povlačenja nakon poraza u bici u Teutoburškoj šumi. Izotopski sastav rimskog olovnog mrtvačkog sanduka, pronađenog u Njemačkoj, pokazuje da ono potiče sjeverno od planine Eifel. Pošto je ruda olovo vrlo često imala primjesa srebra u dovoljnim količinama da se ekonomski isplati njegovo izdvajanje, dobijanje srebra i olova je od antičkih vremena povezano jedno s drugim. Rimljanska prerada olova dovela je do zagađenja okoline, koje se čak i danas može izmjeriti. Istraživanja leda na Grenlandu pokazala su da je u periodu između 5. vijeka p.n.e. i 3. vijeka n.e došlo do mjerljivog porasta sadržaja olova u atmosferi.[9] I kasnije je olovo bilo veoma značajno. Naprimjer koristilo se za vezivanje u vitražnim prozorima u crkvama ili za prekrivanje krovova.
Posebnu važnost olovo dobija nakon izuma vatrenog oružja, koje je koristilo olovo kao materijal za projektile ručnog vatrenog oružja. Pošto su isprva sami vojnici pravili municiju, nije bilo neobično da su krali svo olovo do kojeg su mogli doći.

Olovo je imalo važnu ulogu i u alhemiji. Pošto ima dosta sličnosti sa zlatom (teško i mehko), olovo je smatrano polaznim materijalom za sintezu zlata (sinteza kao promjena boje iz sive u zlatnu). Alhemijski simbol za olovo je stilizirani srp (♄), a od antike je ono bilo metal povezan sa planetom Saturn i istoimenim božanstvom.
Početkom industrijske revolucije olovo je bilo potrebno u sve većim količinama za potrebe hemijske industrije. Koristilo se za proizvodnju sumporne kiseline i za oblaganje opreme za proizvodnju eksploziva. U to vrijeme je ono bilo jedan od najvažnijih obojenih metala.
Danas je olovo po proizvedenoj količini na četvrtom mjestu među obojenim metalima poslije aluminija, bakra i cinka. Gotovo 60% današnje svjetske proizvodnje olovo koristi se za automobilske baterije (olovne akumulatore).
Osobine
[uredi | uredi izvor]Fizičke
[uredi | uredi izvor]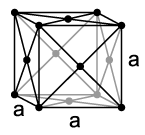
Olovo je neplemeniti metal sa standardnim elektrodnim potencijalom od −0,13 V.[10]. Međutim, ono je mnogo plemenitije od mnogih drugih metala u upotrebi kao što su željezo, cink ili aluminij. Olovo je dijamagnetični teški metal, gustoće 11,3 g/cm3, kristalizira se u kubičnom plošno centriranom sistemu i stoga ima kubično najgušće kuglasto pakovanje. Na njemu se zasniva i izražena duktilnost metala i niska Mohsova tvrdoća od samo 1,5. Olovo koje se javlja u prirodi je obično tvrđe zbog primjesa nečistoća, i ima Mohsovu tvrdoću oko 2-2,5.[11] Ono se lahko izvlači u tanke limove ili žice, međutim zbog malehne tvrdoće nije postojano. Modifikacija olova u vidu dijamanta nije prisutna kod olova, za razliku od lakših homologa iz 14. grupe periodnog sistema. Razlog leži u nestabilnosti veze Pb-Pb uzrokovanom relativističkim efektom i slabom tendencijom da bude četverovalentno.
Olovo ima plavkasto-bijelu boju, na papiru ostavlja sivi trag. Ova osobina se ranije koristila za izradu sredstava za pisanje. Stoga je razvojem izrade olovaka došlo do određenih nejasnoća i zabluda, jer su mnogi mislili da je grafit u olovkama zapravo ruda olova. Tačka topljenja olova je 327 °C, a tačka ključanja između 1740 i 1751 °C. U naučnoj literaturi podaci o tački ključanja se donekle razlikuju, negdje se navodi 1740 °C,[12], 1746 °C[10] i 1751 °C[13]. Olovo provodi električnu struju i toplotu kao mnogi metali, međutim daleko slabije od većine (naprimjer električna provodljivost olova iznosi 4,8 · 106 S/m[13], a srebra 62 · 106 S/m[13]). Na temperaturi ispod 7,196 K olovo ne iskazuje nikakav električni otpor, postaje supraprovodnik tipa I. Brzina zvuka u olovo iznosi oko 1200 m/s, međutim u naučnoj literaturi ti podaci nisu identični, vjerovatno zbog različitog stepena čistoće olova ili načina njegove prerade.
Hemijske
[uredi | uredi izvor]Olovo se pasivizira stajanjem na zraku, jer se na njegovoj površini stvara sloj olovo-oksida koji ga štiti od daljne oksidacije. Svjež presjek olova ima metalni sjaj, ali vrlo brzo potamni zbog stvaranja mat površine. Na zraku fino isitnjeno olovo u prahu tzv. piroforno olovo se pali samo od sebe. Pasivizirano olovo nije rastvorljivo u brojnim kiselinama. Tako je ono otporno u sumpornoj, fluorovodičnoj i hlorovodičnoj kiselini, jer anioni koje ono gradi u njima daju nerastvorljive soli. Zbog toga olovo nalazi primjenu za izradu posebnih hemijskih aparata i opreme. Međutim, olovo se rastvara u razblaženoj dušičnoj kiselini, jer je olovo(II)-nitrat rastvorljiv u vodi. Također se rastvara u koncentriranoj supornoj kiselini stvaranjem rastvorljivih kompleksa Pb(HSO4)2), acetatnoj kiselini (samo uz uvođenje zraka) i vrelim alkalnim rastvorima.
U vodi, koja ne sadrži rastvoren kisik, metalno olovo je stabilno. U prisustvu kisika se lagahno rastvara, stoga olovne vodovodne cijevi predstavljaju određenu opasnost za zdravlje ljudi. Ukoliko voda u sebi ima mnogo hidrogenkarbonata i sulfat, što je prepoznatljivo po takozvanoj tvrdoj vodi, nakon nekog vremena na olovu se formira sloj bazičnih olovo(II)-karbonata i olovo(II)-sulfata. Oni štite vodu od olova, međutim i pored toga manje količine olova ipak mogu dospjeti u vodu.
Rasprostranjenost
[uredi | uredi izvor]
Olovo u Zemljinoj kori nalazi se u koncentraciji od oko 0,0018 %[1][14], ali se ono vrlo rijetko može naći samorodno. Ipak, Međunarodna mineraloška organizacija (IMA) priznaje olovo kao zaseban mineral, odnosno ubraja se u elemente-minerale. Sistematika minerala po Strunzu (9. izdanje) svrstava ga pod sistemski broj 1.AA.05, odnosno po starijem (osmom) izdanju pod broj I/A.05-20. Do 2010. godine, u svijetu je pronađeno 130 mjesta gdje se može pronaći samorodno olovo, između ostalih, Argentina, Etiopija, Australija, Austrija, Belgija, Brazil, Češka, Finska, Francuska, Gruzija, Grčka, Grenland, Italija, Kanada, Kazahstan, Kina, Kirgistan, Meksiko, Mongolija, Namibija, Norveška, Njemačka, Poljska, Rusija, Švedska, Slovenija, Ukrajina, Američka Djevičanska ostrva, Ujedinjeno Kraljevstvo i Sjedinjene Američke Države. Postojanje naslaga olova dokazano je u primjercima stijena iz Srednjeatlantskog grebena i u vanzemaljskim uzorcima poput uzoraka sa Mjesečevog Mora obilja (Mare Fecunditatis)[15]
Olovna ruda je najviše zastupljena u obliku galenita (olovo-sulfid, PbS). Ovaj mineral je također i najvažniji komercijalni izvor za dobijanje olova. Ostali minerali olova su ceruzit (olovo(II)-karbonat, PbCO3 poznat i kao bijela olovna ruda), krokoit (olovo(II)-hromat, PbCrO4, crvena olovna ruda) i anglesit (olovo(II)-sulfat, PbSO4, olovni vitriol). Dva minerala koji imaju najvišu koncentraciju olova u spoju (do 92,8%) su litargit i masicotit. Ukupno je poznato (stanje 2010.) više od 500 minerala olova.[16]
Komercijalne svjetske zalihe rude olova se procjenjuju na oko 67 miliona tona (stanje: 2004.)[17] Najveća nalazišta se nalaze u Kini, SAD, Australiji, Rusiji i Kanadi. U Evropi, zemlje sa najvećim nalazištima su Švedska i Poljska. U Bosni i Hercegovini također se nalaze bogata ležišta ruda olova, najčešće zajedno sa cinkom. Najviše ih ima u okolini Ljubije, Vareša, Olova, Foče, Kreševa i Srebrenice. Te rude se sa područja Bosne i Hercegovine vade i koriste još iz starorimskog perioda.[18] Međutim, danas su dostupna samo ležišta olovne rude kod Vareša, koja se iskopava od 1982. godine.[19] U Njemačkoj rude olova ima u sjevernom Eifelu, Schwarzwaldu, u Saksoniji i drugdje.
Danas je najvažniji izvor olova recikliranje starih olovnih proizvoda. U Njemačkoj, naprimjer, danas postoje još samo dva pogona gdje se olovo proizvodi iz rude (Binsfeldhammer u blizini Stolberga i Metaleurop kod Bremerhavena). Svi ostali pogoni proizvode takozvano sekundarno olovo koje se dobija preradom starog olova (naročito starih automobilskih akumulatora).
Proizvodnja
[uredi | uredi izvor]Ovaj odlomak ili njegov dio sadrži zastarjele podatke. |

| Rang | Država | Proizvedena količina (u 1000 t) |
Rang | Država | Proizvedena količina (u 1000 t) |
|---|---|---|---|---|---|
| 1 | Kina | 950 | 11 | Švedska | 33,9 |
| 2 | Australija | 642 | 12 | Kazahstan | 33 |
| 3 | SAD | 445 | 13 | Maroko | 31,3 |
| 4 | Peru | 306,2 | 14 | Rusija | 24 |
| 5 | Meksiko | 118,5 | 15 | Iran | 22 |
| 6 | Kanada | 76,7 | 16 | Sjeverna Koreja | 20 |
| 7 | Irska | 65,9 | 17 | Bugarska | 19 |
| 8 | Indija | 39,8 | 18 | Turska | 18,7 |
| 9 | Poljska | 38 | 19 | Rumunija | 15 |
| 10 | Južnoafrička Republika | 37,5 | 20 | Brazil | 14,7 |
Najvažnije zemlje proizvođači rude olova 2004. godine bile su Kina, Australija i SAD, čiji zajednički udio u svjetskoj proizvodnji od 3,1 milion tona godišnje je iznosio oko dvije trećine. U Evropi najveći proizvođači bile u Irska, Švedska i Poljska.
Najvažniji proizvođači rafiniranog olova (mehkog olova čistoće 99,99%) bile su također Kina (1,8 miliona tona), SAD (1,2 milion tona) i Njemačka (403.000 tona), čiji udio zajedno je činio oko polovine ukupne svjetske proizvodnje od 6,7 miliona tona. Osim njih, veći proizvođači rafiniranog olova u Evropi bili su Italija, Francuska, Španija i Velika Britanija.
Dobijanje
[uredi | uredi izvor]
Daleko najvažniji mineral olova je galenit. Rude olova se često javljaju zajedno sa sulfidima drugih metala (bakra, bizmuta, cinka, arsena, antimona i dr.), koji predstavljaju prirodne nečistoće sirovog olova maksimalnog udjela do 5%. Putem usitnjavanja, razvrstavanja i flotacije obrađena ruda sa oko 60% sadržaja minerala se uvodi u tri zasebna industrijska procesa za dobijanje olova. Danas procesi redukcije i reakcije prženja su pretežno prevaziđeni, a zamijenjeni su procesom direktnog topljenja, koja je s jedne strane ekonomičnija, a s druge manje šteti okolini.
Ove procedure se provode u dvije faze, prženje i redukcija. Pri prženju fino isitnjeni olovo-sulfid se stavlja na pokretnu traku i kroz njega se provodi vreli zrak zagrijan do 1000 °C. U tom procesu kisik iz zraka reagira u egzotermnoj reakciji dajući olovo(II)-oksid (PbO) i sumpor-dioksid. On se otpušta van zajedno sa drugim gasovima prženja, a može se iskoristiti i za pravljenje sumporne kiseline. Olovo-oksid je u ovim uslovima u tečnom stanju i teče dolje. Kasnije se može sinterirati.
(prženje)
Na kraju slijedi redukcija olovo-oksida pomoću koksa da bi se dobilo metalno olovo. Ovaj proces se dešava u šahtnim pećima, slično kao i kod procesa u visokim pećima. Pri tom se u reakciju uvode dodaci kao što je kreč koji stvara šljaku, uklanjajući nečistoće.
(redukcija)
Moderne metode proizvodnje olova zasnovane su na procesu direktnog topljenja, koji je optimiziran tako da zagađuje okolinu u što je moguće manjoj mjeri ali i uz najmanje moguće troškove. Primjer takvog procesa je takozvana QSL metoda [21]). Prednost te metode je da se proces proizvodnje može odvijati kontinuirano sa ograničenjem na prostor reakcije, gdje se javlja jedini emitent štetnih zagađivača; u odnosu na klasične metode kao što je sinterovanje koje dodatno emitira zagađenje. Prženje i redukcija se odvijaju paralelno u jednom reaktoru. Olovo-sulfid se, kao i u klasičnom procesu prženja, ne prži u potpunosti. Dio olova tako nastaje reakcijom olovo-sulfida sa olovo-oksidom. Pošto je reaktor postavljen blago nagnut na jednu stranu, olovo i šljaka sa velikim sadržajem olovo-oksida teče naniže. Ono prolazi kroz zonu redukcije u kojoj se upumpava prah uglja te se tako olovo-oksid reducira do metalnog olova. Kod prženja umjesto zraka koristi se čisti kisik. Time se značajno smanjuje zapremina otpadnih gasova, nasuprot uobičajene metode koja otpušta veliku koncentraciju sumpor-dioksida. Njegova upotreba za proizvodnju sumporne kiseline je time mnogo lakša i ekonomičnija.
Upotreba
[uredi | uredi izvor]Najveći svjetski potrošači olova su SAD, Japan, Njemačka i Kina. Potrošnja olova jako zavisi od stanja u automobilskoj industriji, koja troši oko 60% svjetske proizvodnje ovog metala. Oko 20% svjetske proizvodnje se prerađuje u hemijskoj industriji. Cijena olova na svjetskom tržištu (stanje april 2014: oko 2075 US dolara/toni[22]) je od početka 21. vijeka snažno porasla, uglavnom zbog povećane potražnje u Kini.

Zaštita od zračenja
[uredi | uredi izvor]Dovoljno debeli blokovi ili slojevi olova vrlo su efikasni u apsorpciji rendgenskog i gama zračenja. Olovo je relativno jeftino i lahko se obrađuje od mnogih metala koji su gušći od njega. Stoga se ono općenito koristi za zaštitu od zračenja u nuklearnoj medicini, radiologiji, terapiji zračenjem i drugim oblastima. Primjer zaštite od zračenja je takozvana olovna pregača koju pacijenti nose prilikom rendgenskog snimanja. Olovno staklo se također koristi za zaštitu od zračenja.
Metal
[uredi | uredi izvor]Olovo se pretežno upotrebljava kao metal ili u nekoj od legura. U odnosu na ranija vremena, kada je olovo bilo jedan od najvažnijih i najviše korištenih metala, danas se ipak pokušava zamijeniti drugim neotrovnim metalima ili legurama. Međutim, ono i dalje ima veliki značaj i primjenu u industriji zbog svojih važnih osobina, najviše zbog otpornosti na koroziju i velike gustoće, kao i lahke proizvodnje i prerade. Elementi koji imaju približnu ili još veću gustoću su naprimjer ili još problematičniji (živa, uranij) ili su isuviše skupi i rijetki (volfram, zlato, platina)
Elektrotehnika
[uredi | uredi izvor]Najveći dio olova se danas upotrebljava kao hemijski izvor energije u olovnim akumulatorima (naprimjer u automobilima). Automobilski akumulator se sastoji iz dvije elektrode: jedne od olova a druge od olovo(IV)-oksida, uronjenih u razblaženu sumpornu kiselinu (37%-tna) koja služi kao elektrolit. Elektrohemijskom reakcijom nastali ioni Pb2+ sa sumpornom kiselinom grade nerastvorljivi olovo(II)-sulfat. Nakon što se akumulator priključi na izvor napajanja, dolazi do suprotne reakcije kada olovo(II)-sulfat prelazi u olovo(IV)-oksid (poznato kao punjenje akumulatora). Prednost olovnih akumulatora je što oni imaju visok nazivni napon po jednoj galvanskoj ćeliji od 2,06 V.
Mašinogradnja
[uredi | uredi izvor]Pošto olovo ima veliku gustoću, često se koristi kao uteg za postizanje veće mase. Zbog toga se kolokvijano ponegdje može čuti izraz teško kao olovo za neke veoma teške predmete ili stvari. Utezi od olovo se između ostalog koriste za postizanje ravnoteže automobilskih felgi. Međutim u EU je od 1. jula 2003. za nova putnička vozila, odnosno od 1. jula 2005. godine za sva vozila (do 3,5t) zabranjena upotreba olova kao utege na felgama, te se oni zamjenjuju utezima od cinka ili bakra. Ostali načini upotrebe koji iskorištavaju veliku gustoću olova su, između ostalih: olovni lanci za izravnjavanje zavjesa i utezi za ronjenje, koji izjednačavaju težinu opreme i ronioca pri ronjenju. Osim toga ono se koristi kao amortizer u nekim automobilskim dijelovima koji su posebno osjetljivi na vibracije, kao stabilizator za brodove kao i posebne slučajeve za zvučnu zaštitu i izolaciju.
Proizvodnja aparata
[uredi | uredi izvor]Zbog svog visokog atomskog broja, olovo je pogodno za zaštitu od gama- i rendgenskog zračenja. Zbog toga se ono upotrebljava za uređaje za usmjeravanje ili filtriranje radioaktivnog zračenja. Također, olovo je osnovni materijal za pregače, kojima se liječnik štiti prilikom rendgenskog snimanja (ukoliko se ne sklanja u posebnu sobu), ili se njome štite pacijenti, kako bi prekrili dijelove tijela koji se ne pregledaju rendgenskim snimanjem. Poseban slučaj primjene olova predstavlja zaštita od zračenja gama-spektrometara za preciznu dozimetriju. U ovu svrhu neophodno je olovo koje i sāmo ima slabu radioaktivnost. Prirodni udio radioaktivnog izotopa 210Pb djeluje negativno. Njegov nivo se smanjuje, što je duži proces topljenja, te se topljenjem iz olova izdvajaju roditeljski nuklidi iz uranij-radijevog niza, koji su pratioci olovne rude. Izotop 210Pb počinje raspadati od trenutka topljenja tokom svog vremena poluraspada od 22,3 godine, bez nastajanja novih količina. Historijski predmeti načinjeni od olova, poput starih brodskih utega iz potonulih brodova ili historijske topovske kugle su posebno traži za dobijanje olovo sa slabijim zračenjem, što je korisno za proizvodnju štitnika od zračenja. Osim toga, postoje brojne druge istraživačke ustanove kojima je neophodno takvo staro olovo.[23]
Vojna tehnika
[uredi | uredi izvor]Vojska je bila i ostala važan korisnik i potrošač olova. Olovo služi kao osnovni materijal za metke i municiju, bilo da se radi o vatrenom oružju ili municiji za praćke. Za staromodne karteče koristilo se isitnjeno olovo i olovne kuglice. Razlog za odabir olova u ovu svrhu bio je sa jedne strane njegova gustoća a time i velika probojna moć, te s druge strane lahka izrada lijevanjem. Danas se olovne kuglice i meci uglavnom oblažu nekim legurama bakra (najčešće mesing). Prednost je uglavnom ta što se postižu veće brzine metka, pošto se olovni meci koji nisu obloženi zbog svoje mehkoće ne mogu ponovno koristiti, a ujedno se onemogućava nakupljanje ostataka olova u unutrašnjosti cijevi oružja.
Ostalo
[uredi | uredi izvor]Olovo(II)-oksid se koristi za glaziranje keramičkih proizvoda, za izradu minijuma, i kao žuta boja u slikarstvu.
Otrovnost
[uredi | uredi izvor]Elementarno olovo se najčešće unosi u organizam kao prašina, te dospijeva u pluća. S druge strane, olovo se gotovo nikako ne može apsorbirati preko kože. Stoga elementarno olovo u kompaktnom obliku nije otrovno za ljude. Osim toga, rastvoreni spojevi olova u vodi, kao i prašina olova, može doći u organizam gutanjem ili pijenjem takve kontaminirane vode. Naročito su otrovni organski olovni spojevi kao što je tetraetil olovo, koje je jako lipofilno i vrlo brzo se može apsorbirati preko kože.
Jednokratnim uzimanjem metalnog olova ili teško rastvorljivih soli olova moguće je primijetiti toksične simptome samo kod velikih doza. Međutim, čak i najmanje količine se talože u organizmu, ako se uzimaju tokom dužeg vremena, tako da se ono skladišti u tijelu najčešće u kostima, a organizam ga može vrlo sporo izbaciti i izlučiti. Olovo može izazvati i hronično trovanje, koje je obilježeno, između ostalog, glavoboljom, zamorom, nedostatkom apetita i lošom krvnom slikom, kao i oštećenjima nervnog i mišićnog sistema. Otrovnost olova je naročito opasna za djecu i trudnice. Ono može izazvati oštećenja fetusa kao i neplodnost. U ekstremnim slučajevima, trovanje olovom može izazvati smrt. Otrovnost olova se objašnjava što ono izaziva smetnje u sintezi hemoglobina. Ono inhibira mnoge enzime i tako onemogućava ugradnju željeza u molekulu hemoglobina. Na taj način olovo ometa opskrbu kisikom ćelija organizma.
Reference
[uredi | uredi izvor]- ^ a b Harry H. Binder (1999). Lexikon der chemischen Elemente. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.
- ^ N. N. Greenwood, A. Earnshaw (1988). Chemie der Elemente (1 izd.). Weinheim: VCH. str. 482. ISBN 3-527-26169-9.
- ^ David R. Lide (izd.): CRC Handbook of Chemistry and Physics. 90. izdanje, (Internet verzija: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, str. 4-142 – 4-147
- ^ a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. u: Journal of Chemical & Engineering Data. 56, 2011, str. 328–337, doi:10.1021/je1011086
- ^ C.A. Sutherland, E.F. Milner, R.C. Kerby, H. Teindl, A. Melin, H.M. Bolt: Lead, u: Ullmann's Encyclopedia of Industrial Chemistry, 2006 Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, doi:10.1002/14356007.a15_193.pub2
- ^ Web elements
- ^ Betina Faist: Der Fernhandel des assyrischen Reiches zwischen dem 14. und dem 11. Jahrhundert vor Christus, u: Alter Orient und Altes Testament, 265, Münster, Ugarit Verlag 2001, str. 45.
- ^ Vitruvije: De architectura 8, 6, 1–3.
- ^ Emsley J (1994): Ancient world was poisoned by lead. New Scientist 143:14.
- ^ a b Michael Binnewies (2004). Allgemeine und anorganische Chemie. Heidelberg: Spektrum. ISBN 3-8274-0208-5.
- ^ Mineralien-Atlas: Olovo; 27. septembar 2006.
- ^ Merck[mrtav link]
- ^ a b c Arnold F. Holleman, Nils Wiberg: Lehrbuch der anorganischen Chemie, de Gruyter, 1995.
- ^ Hans Breuer (2000). Allgemeine und anorganische Chemie. 1 (9 izd.). München: dtv-Atlas Chemie. str. 151. ISBN 3-423-03217-0.
- ^ Mindat – Lead (engl.).
- ^ Webmineral – Mineral Species sorted by the element Pb (Lead) (engl.)
- ^ Fraunhofer-Institut: Trends der Angebots- und Nachfragesituation bei mineralischen Rohstoffen. Arhivirano 10. 3. 2013. na Wayback Machine (PDF, 350 str.).
- ^ Ministarstvo vanjske trgovine i ekonomskih odnosa Bosne i Hercegovine: Izvještaj o stanju životne sredine u BiH za 2012. godinu
- ^ Zovko Emira, Pujić Zdravko, Ćehić Zijad, Bandić Jasmina (2008). "Neutronska aktivaciona analiza rudonosnih dolomita". Hemijska industrija. 62 (1): 1–3. doi:10.2298/HEMIND0801001Z.CS1 održavanje: više imena: authors list (link)
- ^ United States Geological Survey: 2006 - Mineral Resources Program
- ^ "QSL na berzelius.de (arhivirano 29. septembra 2007. na web.archive.org)". Arhivirano s originala, 29. 9. 2007. Pristupljeno 29. 9. 2007.
- ^ London Metal Exchange: Standard Lead. Arhivirano 30. 3. 2014. na Wayback Machine
- ^ Spiegel Online: Neutrino-Jagd, Blei aus antikem Schiff schützt Hightech-Experiment datum: 19. mart 2010







