Wybutozín
| Wybutozín | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C21H28N6O9 |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 508,488 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 55196-46-8 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
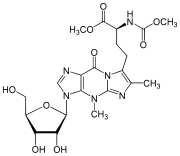
Wybutozín[1] (yW) je modifikovaný nukleozid, ktorý sa nachádza v transferovej RNA fenylalanínu a stabilizuje interakciu medzi kodónom a antikodónom počas proteosyntézy.[2][3] Presný priebeh syntézy bielkovín je esenciálny pre zdravie bunky, inak môžu poruchy modifikácií tRNA spôsobiť choroby. U eukaryotických organizmov sa wybutozín nachádza len na pozícii 37, teda na 3' strane antikodónu, v tRNA fenylalanínu. Wybutozín zaručuje správnu transláciu vďaka stabilizácii párovania báz pri kodón-antikodónovej interakcii.[4]
Biosyntetická dráha
[upraviť | upraviť zdroj]Biosyntetická dráha wybutozínu bola navrhnutá s použitím modelu S. cerevisiae. Prvý krok syntézy katalyzuje N1-metyltransferáza TRM5, ktorá metyluje G37 tRNA fenylalanínu a mení ho na m1G37. Následne je m1G37 substrátom pre enzým TYW1, ktorý pomocou pyruvátu vytvorí tricyklické jadro wybutozínu. Kofaktorom tejto reakcie je FMN. Enzým TYW2 potom prenáša α-amino-α-karboxypropylovú skupinu zo SAM, ktorý sa bežne používa ako kofaktor pri prenosoch metylovej skupiny, na bočnú C7 pozíciu yW-187, čím vzniká yW-86. Enzým TYW3 potom katalyzuje N-4 metyláciu yW-86, čím vzniká yW-72. TYW4 a SAM-dependentná karboxymetyltransferáza potom metylujú α-karboxylovú skupinu yW-72 za vzniku yW-57. Posledným krokom, ktorý katalyzuje druhá aktivita TYW4, je metoxykarbonylácia α-amino skupiny bočného reťazca yW-58, čím vzniká wybutozín.[5]

Wybutozín sa podarilo syntetizovať i chemicky.[6][7]
Úloha hypermodifikácií v stabilizácii RNA
[upraviť | upraviť zdroj]Bolo navrhnuté, že wybutozín a iné nezvyčajné nukleozidy vedú k jedinému výsledku hypermodifikácie. Táto hypermodifikácia tRNAPhe na pozícii 37 umožňuje skladanie báz na seba (stacking), ktoré má dôležitú úlohu v udržiavaní čítacieho rámca.[8] Vďaka veľkým aromatickým skupinám sa zlepšuje skladanie s bázami A36 a A38, čo znižuje flexibilitu antikodónu.[9] Bolo zistené, že keď tRNAPhe nemá wybutozín, dochádza k posunu čítacieho rámca. Všeobecne modifikácie na pozícii 37 zabraňujú párovaniu báz so susednými nukleotidmi vďaka udržiavaniu a otvoreniu kruhovej konformácie, ako i tvorbou antikodónového kruhu na dekódovanie. Wybutozínová modifikácia tRNAPhe je zachovaná u arcehónov i eukaryot, ale nenachádza sa u baktérií. Štúdie z rokov 1960-1980 ukázali, že mnoho mutácií môže viesť k problémom s presnou transláciou. Ďalšie štúdie mechanizmov presnosti translácie ukázali dôležitosť modifikácií tRNA na pozíciách 34 a 37. Bez ohľadu na živočíšny druh sú tieto pozície takmer vždy modifikované. To, že wybutozín a jeho rôzne deriváty sa nachádzajú len na pozícii 37, naznačuje povahu fenylalanínových antikodónov, UUU a UUC, a ich náchylnosti k ribozómovému slkzu.[10] Na základe toho vznikol predpoklad, že modifikácia tRNAPhe na pozícii 37 koreluje s množstvom polyuridínových klzkých sekvencií v genómoch.[11]
Potenciál pre posun čítacieho rámca
[upraviť | upraviť zdroj]Úloha wybutozínu v zabránení posunu čítacieho rámca vyvolala otázky ohľadne jeho významu, keďže existujú i iné stratégie proti posunu čítacích rámcov okrem modifikácie s použitím yW. U rodu Drosophila nie je žiadna modifikácia na pozícii 37, ale u cicavcov je na tejto pozícii modifikovaný yW. Na vysvetlenie tejto variability bol navrhnutý potenciál pre posun čítacieho rámcu. Ten naznačuje, že bunky využívajú posun čítacieho rámca na reguláciu a nesnažia sa mu za každú cenu vyhnúť.[12] Takisto bolo navrhnuté, že bunky využívajú posun čítacieho rámcu predprogramovaným spôsobom, čím sa zvyšuje diverzita.
Referencie
[upraviť | upraviť zdroj]- ↑ Analógy oligonukleotidov cielené proti ľudskému LMNA - EP 2788487 [online]. wbr.indprop.gov.sk, [cit. 2022-02-11]. Dostupné online.
- ↑ Biosynthesis of wybutosine, a hyper-modified nucleoside in eukaryotic phenylalanine tRNA. EMBO J., 2006, s. 2142–54. DOI: 10.1038/sj.emboj.7601105. PMID 16642040.
- ↑ Wybutosine biosynthesis: Structural and mechanistic overview. RNA Biology, 2 December 2014, s. 1508–1518. DOI: 10.4161/15476286.2014.992271. PMID 25629788.
- ↑ Crystal Structure of the Radical SAM Enzyme Catalyzing Tricyclic Modified Base Formation in tRNA. Journal of Molecular Biology, October 2007, s. 1204–1214. DOI: 10.1016/j.jmb.2007.07.024. PMID 17727881.
- ↑ a b YOUNG, Anthony P.; BANDARIAN, Vahe. Radical SAM Enzymes. [s.l.] : [s.n.], 2018. ISBN 978-0-12-812794-0. DOI:10.1016/bs.mie.2018.04.024 TYW1: A Radical SAM Enzyme Involved in the Biosynthesis of Wybutosine Bases, s. 119–153.
- ↑ Practical synthesis of wybutosine, the hypermodified nucleoside of yeast phenylalanine transfer ribonucleic acid. Chem. Pharm. Bull., 2002, s. 530–3. DOI: 10.1248/cpb.50.530. PMID 11964003.
- ↑ Total synthesis of the hypermodified RNA bases wybutosine and hydroxywybutosine and their quantification together with other modified RNA bases in plant materials. Chemistry, 2013, s. 4244–8. DOI: 10.1002/chem.201204209. PMID 23417961.
- ↑ Posttranscriptional RNA Modifications: playing metabolic games in a cell's chemical Legoland. Chem. Biol., 2014, s. 174–85. DOI: 10.1016/j.chembiol.2013.10.015. PMID 24315934.
- ↑ Naturally-occurring modification restricts the anticodon domain conformational space of tRNA(Phe). J Mol Biol, 2003, s. 901–18. DOI: 10.1016/j.jmb.2003.09.058. PMID 14643656.
- ↑ Control of catalytic cycle by a pair of analogous tRNA modification enzymes. J Mol Biol, 2010, s. 204–17. DOI: 10.1016/j.jmb.2010.05.003. PMID 20452364.
- ↑ Transfer RNA modifications: nature's combinatorial chemistry playground. Wiley Interdiscip Rev RNA, 2013, s. 35–48. DOI: 10.1002/wrna.1144. PMID 23139145.
- ↑ Role of a tRNA Base Modification and Its Precursors in Frameshifting in Eukaryotes. Journal of Biological Chemistry, September 2007, s. 26026–26034. DOI: 10.1074/jbc.m703391200. PMID 17623669.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Wybutosine na anglickej Wikipédii.
