Acido alginico
| Acido alginico | |
|---|---|
 | |
| Nomi alternativi | |
| E400 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | (C6H8O6)n |
| Massa molecolare (u) | 10,000 - 600,000 |
| Aspetto | polvere di colore variabile dal bianco al giallo-marroncino |
| Numero CAS | |
| Numero EINECS | 232-680-1 |
| DrugBank | DBDB13518 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1.601 |
| Costante di dissociazione acida (pKa) a 298,15 K | 1.5-3.5 |
| Indicazioni di sicurezza | |
L'acido alginico, anche chiamato algina, è un polisaccaride ampiamente presente nelle pareti cellulari delle alghe brune. Il suo colore spazia dal bianco al giallo-marroncino. Viene venduto in forma filamentosa, granulare o in polvere.
I suoi derivati, chiamati alginati sono usati come addensanti e stabilizzanti nell'industria alimentare, farmaceutica e cosmetica.
Storia
[modifica | modifica wikitesto]La struttura dell'acido alginico fu inizialmente investigata nel 1955 da Fischer e Dörfel che hanno confermato la presenza di acido D-mannuronico e stabilito la presenza di residui di acido L-guluronico nell'alginato. Essi effettuarono una separazione dei residui di idrolisi dell'acido alginico tramite cromatografia. Trovarono che le proporzioni in cui erano presenti i due monomeri non era costante ma differiva a seconda del campione da un rapporto di 2:1 a un rapporto di 1:2[1]. Questa scoperta fu in seguito confermata da Whistler, Kirby, Drummond, Hirst e Percival[2][3].
Nel 1960 Vincent tentò una idrolisi dell'acido alginico con acido solforico concentrato. Ottenne dimeri e oligomeri uronici[4]. Gli studi di Hirst e Rees chiarirono che la struttura del polimero era lineare e costituita da monomeri di acido D-mannuronico e L-guluronico tramite legami 1,4[5][6].
Tentativi di idrolisi enzimatica da parte di Yoshikawa e Kiyohara nel 1963 portarono a isolare trimeri uronici[7].
Proprietà chimico-fisiche
[modifica | modifica wikitesto]L'acido alginico è un acido poliuronico, insapore e insolubile in acqua fredda ma mostra una debole solubilità in acqua calda. Viene idrolizzato con difficoltà tramite acidi a caldo (sono note idrolisi con acido cloridrico, solforico e ossalico)[8][9][5][4]. In uno studio del 1966, utilizzando acido ossalico 1 M a 100 °C si è riusciti a idrolizzare il 30% di un campione di acido alginico (da alghe Laminaria digitata)[5]. Esso ha comportamento debolmente acido derivante dal carbossile libero presente in ogni unità monomerica[8].
Quando viene estratto, tramite triturazione, forma con l'acqua una gomma viscosa.
L'acido alginico può assorbire fino a 200-300 volte la propria massa in acqua[10] e fino al 60% della propria massa in sali[8].
È dotato di attività ottica[8]. Per aumentarne la solubilità viene utilizzato come sale di metalli alcalini.
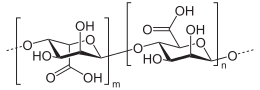
Struttura
[modifica | modifica wikitesto]L'acido alginico è un copolimero lineare con blocchi omopolimerici di α-D-mannuronato (M) legati con legami covalenti 1-4 con residui del suo epimero β-L-guluronato (G) in differenti sequenze di blocchi. I monomeri possono essere blocchi omopolimerici di residui G consecutivi (blocchi G), blocchi di residui M consecutivi (blocchi M) o blocchi costituiti da residui M e G alternati (blocchi MG).
Proprietà biologiche
[modifica | modifica wikitesto]L'acido alginico non è sintetizzato nel corpo umano e gli enzimi digestivi non sono in grado di disgregarlo.
Fonti
[modifica | modifica wikitesto]Gli alginati vengono estratti dalle alghe marine e raffinati. In tutto il mondo viene raccolta un'ampia gamma di alghe brune del phylum Phaeophyceae per essere convertite in materiale grezzo, alginato di sodio.
Le alghe possono essere classificate in tre vasti gruppi basandosi sulla loro pigmentazione: brune, rosse e verdi. Questi vasti gruppi sono rispettivamente le Phaeophyceae, le Rhodopyceae e le Chlorophyceae. Le alghe brune sono solitamente più grandi, e spaziano dalle dimensioni dell'alga gialla gigante Macrocystis pyrifera lunga 20 metri, ad alghe sottili, simili a pelle lunghe 2-4 metri, alle specie più piccole lunghe 30-60 cm. Nessuna delle alghe utilizzate nella produzione dell'alginato viene coltivata in quanto esse non possono essere coltivate con mezzi vegetativi ma devono compiere un ciclo riproduttivo che include un alternarsi di generazioni. Per questo motivo le alghe brune coltivate risultano eccessivamente costose in confronto ai costi di raccolta e trasporto delle alghe selvatiche. L'unica eccezione è rappresentata dalla Laminaria japonica, che viene coltivata in Cina come cibo e il cui eccesso viene deviato verso l'industria dell'alginato della Cina.
L'alginato ottenuto da differenti specie di alghe brune vede spesso variare la propria struttura chimica e, di conseguenza, mostra proprietà fisiche differenti. Per esempio, a seconda delle alghe, l'alginato può dare gel più o meno solidi oppure si possono ottenere alginati più chiari o più scuri (questi ultimi verranno utilizzati in impieghi nei quali il colore non è un problema).[11]
Le varietà commerciali di alginato sono estratti dalle alghe giganti Macrocystis pyrifera, Ascophyllum nodosum e vari tipi di Laminaria. Viene anche prodotta da due generi di batteri, gli Pseudomonas e gli Azotobacter, che giocano un ruolo di primaria importanza nello svolgimento del suo percorso biosintetico. Gli alginati di origine batterica sono utili per la produzione di micro o nanostrutture adatte per applicazioni mediche.[12]
Produzione
[modifica | modifica wikitesto]Il processo di produzione dell'alginato di sodio a partire dalle alghe brune può avvenire in due modi: tramite il metodo dell'alginato di calcio o tramite il metodo dell'acido alginico. La chimica dei processi usati per produrre alginato di sodio è relativamente semplice.
Per estrarre l'acido alginico si pongono le alghe in un bagno di carbonato di sodio sfruttando il fatto che gli alginati alcalini sono solubili in acqua. Dalla soluzione ottenuta si riottiene l'acido alginico tramite precipitazione con acido cloridrico o acido solforico[9].
La difficoltà dei processi sta nelle separazioni fisiche richieste, come nella filtrazione di residui fangosi da soluzioni viscose o nella separazione di precipitati gelatinosi che trattengono una grande quantità di liquido nella propria struttura e che resistono alla filtrazione e alla centrifugazione.
Alginati
[modifica | modifica wikitesto]Gli alginati sono i sali dell'acido alginico. Gli alginati dei metalli alcalini e del magnesio sono solubili in acqua. Insolubili sono, invece, gli alginati di calcio, alluminio e ferro[8].
Le mucillagini preparate con gli alginati solubili sono instabili a un pH inferiore a 4 e in presenza di ioni calcio e di metalli pesanti.
L'alginato di sodio è il sale di sodio dell'acido alginico. La sua formula empirica è NaC6H7O6. L'alginato di sodio è una gomma, estratta dalle pareti cellulari delle alghe brune. L'alginato di sodio ha vari impieghi in numerose industrie come quella alimentare, nella stampa tessile e in farmaceutica. Il materiale delle impronte dentali utilizza l'alginato come materiale da stampo. L'alginato non è pericoloso al contatto con la pelle né per ingestione.
L'alginato di potassio è il sale di potassio dell'acido alginico. Viene estratto dalle alghe e ha formula chimica KC6H7O6.
L'alginato di calcio, ottenuto per reazione di sostituzione dall'alginato di sodio, ha formula chimica C12H14CaO12. Trova impiego in medicamenti e garze emostatiche.
Utilizzi
[modifica | modifica wikitesto]L'alginato assorbe acqua rapidamente e questo lo rende utile come additivo nei prodotti disidrati come integratori dimagranti, e nella produzione di carta e fibre tessili simili alla seta. Viene anche usato per produrre articoli impermeabili e ignifughi come agente gelificante, e come addensante in gelati e cosmetici.
Nell'industria tessile viene usato per produrre la fibra alginica, costituita di alginato di calcio e prodotta per la prima volta nel 1944. Il processo di produzione vede trasformare l'acido alginico in alginato di sodio e poi in alginato di calcio tramite aggiunta di sali adatti. Esso viene usato come supporto per la produzione di merletti, in quanto eliminabile tramite lavaggio alcalino, e in diversi tipi di prodotti medici tra cui nella produzione di garze usate per promuovere la guarigione delle ustioni che possono essere rimosse causando meno dolore delle garze convenzionali. Questo è dovuto al fatto che i tessuti umani sono in grado di assorbirlo senza conseguenze avverse.[9]
Viene impiegato nei prodotti per lucidare la carrozzeria delle automobili e nelle vernici.
L'alginato viene usato in vari preparati farmaceutici come il Gaviscon. L'alginato è ampiamente usato come materiale da stampo in odontoiatria, nella produzione di protesi e nella produzione di positivi per colate su piccola scala. Viene anche utilizzato nell'industria alimentare per addensare zuppe e gelatine.
A causa della sua biocompatibilità e della semplicità con cui può essere gelificato con ioni bivalenti come Ca2+, l'alginato viene ampiamente usato nell'immobilizzazione e incapsulazione delle cellule.
L'acido alginico è usato anche nelle arti culinarie e in particolare nelle tecniche di sferificazione di Ferran Adrià[13].
A causa della sua capacità di assorbire rapidamente l'acqua, l'alginato può essere trasformato tramite un processo di liofilizzazione in una nuova struttura che ha la capacità di espandersi. In questo senso viene utilizzato nell'industria dimagrante come anoressizzante.
Nel marzo 2010 dei ricercatori dell'Università di Newcastle hanno annunciato che utilizzando alginati nella dieta l'assorbimento di grassi nel corpo umano diminuisce di più del 75%[14].
Oltre a questi impieghi gli alginati sono impiegati anche nell'industria dei colori e degli inchiostri[8].
Note
[modifica | modifica wikitesto]- ^ (DE) F. G. Fischer, H. Z. Dörfel, Die Polyuronsäuren der Braunalgen (Kohlenhydrate der Algen I) (abstract), in Hoppe-Seyler's Zeitschrift fur physiologische Chemie, n. 302, 1955, pp. 186-203. URL consultato il 19 aprile 2015.
- ^ (DE) Roy L. Whistler, Kenneth W. Kirby, Notiz über die Zusammensetzung der Alginsäure von Macrocystis pyrifera, in Hoppe-Seyler's Zeitschrift fur physiologische Chemie, n. 314, 1959, pp. 46-48.
- ^ (EN) D. W. Drummond, E. L. Hirst, Elizabeth Percival, The constitution of alginic acid, in Journal of the Chemical Society, 1962, pp. 1208-1216, DOI:10.1039/JR9620001208.
- ^ a b D. L. Vincent, Oligosaccharides from alginic acid, in Chemistry & Industry, 1960, p. 1109.
- ^ a b c Arne Haug, Bjørn Larsen, Olav Smidsrød, A study of the constitution of alginic acid by partial acid hydrolysis (PDF), in Acta Chemica Scandinavica, n. 20, 1966, pp. 183-190. URL consultato il 18 aprile 2015 (archiviato dall'url originale il 18 aprile 2015).
- ^ Edmund Hirst, Sir and D. A. Rees, The structure of alginic acid. Part V. Isolation and unambiguous characterization of some hydrolysis products of the methylated polysaccharide, in Journal of the Chemical Society, 1965, pp. 1182-1187.
- ^ M. Yoshikawa, T. Kiyohara, Oligosaccharides obtained by enzymic cleavage of alginate. II, in Science Reports of the Hyogo University of Agriculture, Series, Agriculture & Chemistry, n. 6, 1963, p. 51.
- ^ a b c d e f alginico, acido, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana. URL consultato il 5 gennaio 2023.
- ^ a b c Sapere.it De Agostini, algìnico, su sapere.it. URL consultato il 18 aprile 2015.
- ^ (EN) Raymond C. Rowe, Paul J. Sheskey, Marian E. Quinn, Handbook of Pharmaceutical Excipients (Rowe, Handbook of Pharmaceutical Excipients), Sesta, Pharmaceutical Pr, 2009, p. 11–12, ISBN 0-85369-792-2.
- ^ FAO FISHERIES TECHNICAL PAPER 441, Dennis J. McHugh, School of Chemistry, University College, University of New South Wales and Australian Defence Force Academy Canberra Australia
- ^ (EN) Remminghorst and Rehm, Microbial Production of Alginate: Biosynthesis and Applications, in Microbial Production of Biopolymers and Polymer Precursors, Caister Academic Press, 2009, ISBN 978-1-904455-36-3.
- ^ Lo Mejor de la Gastronomia, su StarChefs.com. URL consultato il 14 novembre 2007 (archiviato dall'url originale il 1º dicembre 2007).
- ^ Seaweed to tackle rising tide of obesity, su ncl.ac.uk, Newcastle University. URL consultato il 22 marzo 2010 (archiviato dall'url originale il 25 marzo 2010).
Voci correlate
[modifica | modifica wikitesto]- Acido ialuronico: un polisaccaride simile negli animali.
- Alginato di sodio
- Alginato di potassio
- Alginato di calcio
Collegamenti esterni
[modifica | modifica wikitesto]- alginico, acido, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- algina / algìnico, su sapere.it, De Agostini.
- (EN) algin / alginate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 20943 · BNF (FR) cb155565775 (data) |
|---|
