Oxid de staniu (II)
| Oxid de staniu (II) | |
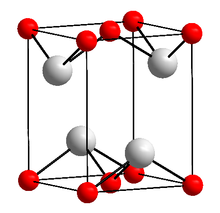 __ Sn2+ __ O2− | |
 | |
| Nume IUPAC | Oxid de staniu (II) |
|---|---|
| Alte denumiri | Oxid stanos Monoxid de staniu |
| Identificare | |
| Număr CAS | 21651-19-4 |
| PubChem CID | 88989 |
| Informații generale | |
| Formulă chimică | SnO |
| Aspect | pudră neagră sau roșie (anhidru) alb (hidrat) |
| Masă molară | 134,709 g/mol |
| Proprietăți | |
| Densitate | 6,45 g/cm3 |
| Starea de agregare | solidă |
| Punct de topire | 1 080 °C |
| Structură cristalină | Sistem cristalin tetragonal |
| Presiune de vapori | 0 mm Hg[1] |
| Pericol | |
Nelistat | |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
| Modifică date / text | |
Oxidul de staniu (II) (de asemenea cunoscut și ca oxid stanos) este un compus anorganic cu formula SnO. Este format din staniu și oxigen, metalul având starea de oxidare +2. Există două forme: forma stabilă de culoare albastru-neagră și o formă metastabilă de culoare roșie.
Obținere și reacții
[modificare | modificare sursă]
Forma stabilă a oxidului de staniu poate fi preparată prin încălzirea oxidul de staniu (II) hidrat, SnO·xH2O (x<1), care este precipitat când o sare de staniu (II) este reacționată cu o bază alcalină, cum ar fi hidroxidul de sodiu (NaOH). [2] Metastabil, oxidul de staniu roșu poate fi preparat prin încălzirea la temperaturi mici a precipitatului produs prin acțiunea amoniacului în soluție cu o sare de staniu (II). [2] Oxidul de staniu poate fi preparat ca substanță pură în laborator, prin încălzirea controlată a oxalatului de staniu (II) în absența aerului. [3]
Oxidul de staniu (II) arde în aer cu o flamă verde, formând dioxidul de staniu (SnO2): [2]
Referințe
[modificare | modificare sursă]- ^ http://www.cdc.gov/niosh/npg/npgd0615.html Lipsește sau este vid:
|title=(ajutor) - ^ a b c Egon Wiberg, Arnold Frederick Holleman (2001) Inorganic Chemistry, Elsevier ISBN 0-12-352651-5
- ^ Satya Prakash (2000),Advanced Inorganic Chemistry: V. 1, S. Chand, ISBN 81-219-0263-0



