Metathese (scheikunde)
Metathesereacties (kortweg: metathese; van het Griekse μετάθεσις, omzetting) of dubbele uitwisselingsreacties zijn in het algemeen chemische reacties van het volgende type:
Hierbij wisselen delen van twee reagerende structuren van positie. Metathesereacties treden vaak, maar niet noodzakelijk, op in waterig milieu.
Metathese in de anorganische chemie
[bewerken | brontekst bewerken]In de anorganische chemie zijn talrijke metathesereacties bekend. Ze kunnen ruwweg in drie groepen verdeeld worden:
- Reacties waarbij neerslagvorming optreedt
- Reacties waarbij gasvorming optreedt
- Reacties waarbij een zwak elektrolyt gevormd wordt

Neerslagvorming
[bewerken | brontekst bewerken]Een metathese kan voorkomen tussen twee anorganische zouten als een van de producten niet oplosbaar is in water, waardoor het evenwicht van de reactie verdreven wordt, zoals in de volgende reactievergelijking:
In bovenstaand geval wordt zilverchloride gevormd, dat een onoplosbaar zout is en neerslaat als een witte vaste stof. Het gevormde natriumnitraat is goed oplosbaar in water en is dus volledig gedissocieerd.
Een zeldzamer geval is een metathese waarbij toch twee oplosbare zouten gevormd worden, voldoende sterk verschillend in oplosbaarheid zodat ze gescheiden kunnen worden. Een voorbeeld van een dergelijke reactie is de vorming van ammoniumperchloraat uit natriumperchloraat en ammoniumchloride:
Gasvorming
[bewerken | brontekst bewerken]Een andere manier waarop metathese plaatsgrijpt is deze waarbij een der reactieproducten een gas is, dat uit het reactiemengsel ontwijkt. Een voorbeeld is de vorming van waterstofsulfide door reactie van natriumsulfide met een zuur (waterstofchloride):
Deze metathesereactie berust op het thermodynamisch principe van een sterke toename in entropie van het systeem.
Vorming van een zwak elektrolyt
[bewerken | brontekst bewerken]Het laatste type metathesereactie gaat door omdat zich een weinig gedissocieerd of zwak elektrolyt vormt. Dit zijn typisch zuur-basereacties, waarbij een zout en water gevormd worden. Het gevormde water is het zwak elektrolyt, omdat dit weinig tot niet dissocieert in water (wegens de autoprotolyse van water). Het zout is uiteraard wel gedissocieerd in waterig milieu (tenzij het onoplosbaar is). De meest klassieke reactie is deze tussen waterstofchloride en natriumhydroxide:
Metathese in de organische chemie
[bewerken | brontekst bewerken]Een van de belangrijkste reacties in de organische chemie is de alkeenmetathese (vaak kortweg metathese genoemd), en de verwante alkynmetathese. Bij de alkeenmetathese zorgt een metaalcomplex als katalysator (zoals een Grubbs' katalysator) ervoor dat twee helften van een alkeen als het ware van plaats kunnen wisselen:
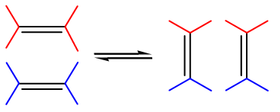
In 2005 werd de Nobelprijs voor de Scheikunde toegewezen aan Yves Chauvin, Richard R. Schrock en Robert H. Grubbs voor hun bijdragen tot de ontwikkeling van de alkeenmetathese in organische synthese.





