Natriumnitraat
| Natriumnitraat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
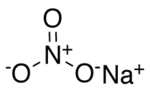
Structuurformule van natriumnitraat
| ||||

| ||||
Natriumnitraat-kristallen
| ||||
| Algemeen | ||||
| Molecuulformule | NaNO3 | |||
| IUPAC-naam | natriumnitraat | |||
| Andere namen | chilisalpeter, natronsalpeter, nitratine | |||
| Molmassa | 84,994669 g/mol | |||
| SMILES | [N+](=O)([O-])[O-].[Na+]
| |||
| InChI | 1S/NO3.Na/c2-1(3)4;/q-1;+1
| |||
| CAS-nummer | 7631-99-4 | |||
| EG-nummer | 231-554-3 | |||
| PubChem | 24268 | |||
| Wikidata | Q184373 | |||
| Beschrijving | Kleurloos tot wit poeder | |||
| Vergelijkbaar met | ammoniumnitraat, kaliumnitraat | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H272 - H302 - H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P220 - P261 - P305+P351+P338 | |||
| Hygroscopisch? | ja | |||
| Opslag | verwijderd houden van hitte, vonken en open vlammen | |||
| VN-nummer | 1498 | |||
| LD50 (ratten) | (oraal) 1267 mg/kg | |||
| LD50 (konijnen) | (oraal) 2680 mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Dichtheid | 2,26 g/cm³ | |||
| Smeltpunt | 308 °C | |||
| Kookpunt | (ontleedt) 380 °C | |||
| Goed oplosbaar in | water | |||
| Slecht oplosbaar in | ethanol | |||
| Onoplosbaar in | hexaan, benzeen, tolueen | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | trigonaal | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−452 kJ/mol | |||
| ΔfH |
−468 kJ/mol | |||
| S |
117 J/mol·K | |||
| Nutritionele eigenschappen | ||||
| E-nummer | E251 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Natriumnitraat is het natriumzout van salpeterzuur, met als brutoformule NaNO3. De zuivere stof komt voor als een zeer hygroscopisch kleurloos tot wit kristallijn poeder, dat zeer goed oplosbaar is in water.
Synthese
[bewerken | brontekst bewerken]Natriumnitraat kan bereid worden door reactie van natriumcarbonaat of natriumhydroxide met salpeterzuur:
Eigenschappen en voorkomen
[bewerken | brontekst bewerken]Zoals de meeste nitraten is natriumnitraat een zeer goed in water oplosbaar zout. Doordat natriumnitraat zeer hygroscopisch is wordt het zelden in vrije vorm in de natuur aangetroffen. Een uitzondering op deze regel kan voorkomen in extreme klimaatomstandigheden zoals in Chili: op eilanden voor de kusten waar vrijwel nooit regen valt nestelen soms enorme aantallen zeevogels in kolonies. Duizenden jaren lang hebben deze vogelkolonies mest of guano opgestapeld bij het uitbroeden van hun eieren. De resulterende mestlaag, die rijk is aan nitraten door het eiwitrijke visdieet van de vogels, kan daar vele meters dik zijn en is lang als grondstof gewonnen. Naar de vindplaats wordt deze grondstof Chilisalpeter genoemd. Het is voornamelijk natriumnitraat en was vóórdat het Haber-Boschproces voor bereiding van ammoniak uit waterstof en stikstof ontwikkeld werd, een begeerde delfstof.
Voor de koloniale tijd en de ontdekking van Chilisalpeter werd kaliumnitraat moeizaam gewonnen uit mesthopen. Dit vormde de voornaamste grondstof voor de bereiding van zwart buskruit (een explosief mengsel, dat naast kaliumnitraat ook zwavel en houtskool bevatte).
Bij verhitting boven 380 °C ontleedt natriumnitraat tot natriumnitriet en zuurstofgas:
Temperaturen boven 800 °C leiden tot vorming van natriumoxide:
Toepassingen
[bewerken | brontekst bewerken]Natriumnitraat kan gebruikt worden om in het laboratorium in situ salpeterzuur te bereiden:
Natriumnitraat werd vroeger gebruikt als meststof en bij de productie van buskruit. Natriumnitraat is een voedingsadditief (een conserveermiddel) met als E-nummer E251. Na consumptie wordt nitraat in het lichaam omgezet in nitriet, waarna het dezelfde bijwerking heeft als E250, natriumnitriet. Dit gebeurt door enzymen in het speeksel, maar ook door bacteriën in het maag-darmkanaal.
Externe links
[bewerken | brontekst bewerken] natriumnitraat - International Chemical Safety Card
natriumnitraat - International Chemical Safety Card- (en) Gegevens van natriumnitraat in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van natriumnitraat







