Nitrata acido
| Nitrata acido | ||
| ||
|
| |
| Alternativa(j) Nomo(j) | ||
| Nitrata acido Acidum nitricum[1] | ||
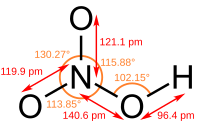
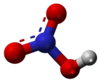
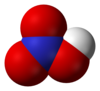
| Kemia formulo | HNO3 | |
| PubChem-kodo | 944 | |
| ChemSpider kodo | 919 | |
| CAS-numero-kodo | 7697-37-2 | |
| Karakterizaĵoj | ||
| Molmaso | 63,01 g·mol−1 | |
| Denseco | 1.5129 g/mL (liquid) | |
| Fandopunkto | −42 °C (−44 ℉; 231 K) | |
| Bolpunkto | 83 °C (181 ℉; 356 K) | |
| Refrakta indico | 1.397 (16.5 °C) | |
| Akva solvebleco | komplete solvebla | |
| pKa | -1,4 | |
| Sekurecaj Indikoj | ||
| Riskoj | 8 35 | |
| Sekureco | 1/2 23 26 36 45 | |
| Danĝero |
| |
Nitrata acido (HNO3) estas senkolora, fumanta, tre kaŭstika fluidaĵo kun fandopunkto de −42 °C kaj bolpunkto de 83 °C. Ĝi estas ofte uzata laboratoria reagento kaj grava industria kemiaĵo: oni uzas ĝin por produkto de kemisterko, eksplodaĵoj. Ĝi estas venena materialo, kaŭzas brulvundojn.
Jam la alkemiistoj produktis kaj uzis la nitratan acidon. Oni pli poste aplikis la simplan laboratorian metodon de germana kemiisto Johann Rudolph Glauber (1648): oni produktis ĝin per komuna varmigo de kalia nitrato kaj sulfura acido. Antoine-Laurent Lavoisier en 1776 pruvis, ke la ænitrata acido entenas oksigenon kaj en 1816 Joseph-Louis Gay-Lussac kaj Claude Louis Berthollet klarigis ties kemian konsiston.
Hodiaŭ oni produktas la nitratan acidon per kataliza oksidigo de amonio. La procedon ellaboris la germano Wilhelm Ostwald en 1901. Oni oksidas la amoniogason per aero aŭ oksigeno al nitrogena monoksido, poste al nitrogena dioksido ĉe ĉeesto de platenoreta katalizatoro. Oni kondukas la nitrogenan dioksidon en akvon por estigi nitratan acidon. Oni povas forigi la akvon el la estiĝanta solvaĵo (kiu entenas 50–70-mas-procente acidon) per sulfuracida distilado.
La nitrata acido malkombiniĝas al akvo, nitrogen-dioksido kaj oksigeno, dume formiĝas brunflava fluidaĵo. Kun partopreno de forta acido, en kavo, ĝi transformiĝas tute al hidrogen- kaj nitratjonoj. Ĝi estas forta oksidaĵo, tio estas, akceptas elektronojn dum la redoksaj reakcioj.
La nitrata acido havas la sekvajn utilajn reakciojn:
- la neŭtraligo per aminio produktas amonio-nitraton, bazkomponanton de la kemisterkoj.
- la nitrigo de glicerino kaj tolueno rezultas estiĝon de la eksplodaĵoj nitro-glicerino kaj trinitro-tolueno (toluena trinitrato)
- produkto de nitro-celulozo
- oksidigo de metaloj al konvenaj oksidoj kaj nitratoj.
Vidu ankaŭ
[redakti | redakti fonton]Referencoj
[redakti | redakti fonton]- ↑ British Pharmacopoeia

