Убіквітин-залежний протеоліз
Убіквітин-залежний протеоліз — процес гідролізу (розщеплення) аномальних та вже непотрібних білків організму, що здійснюється так званою убіквітин-протеасомною системою. Процес включає два етапи: ковалентне приєднання ланцюжка молекул убіквітину і деградацію білка протеасомою.
Клітинам потрібний механізм деградацій білків, що вже виконали свою функцію і стають непотрібними. Подальша присутність таких білків у клітині може їй нашкодити, крім того, потрібні амінокислоти для синтезу інших білків, а перевантаження цитоплазми поліпептидами може індукувати апоптоз[1]. Довгий час внутрішньоклітинний протеоліз вважали неспецифічним процесом, справжнім проривом у цій галузі стало відкриття убіквітин-залежного протеолізу. Серед субстратів специфічного протеолізу є регулятори клітинного циклу, компоненти різних сигнальних шляхів, мутантні білки, а також пошкоджені посттрансляційно. Довго вважали, що такий протеоліз може мати місце лише для білків цитоплазми та, можливо, ядра. Нині стало зрозуміло, що ця система працює і для білків, зв'язаних з мембранами, білків, що секретуються (для цього потрібне зворотне переміщення білка у клітину). Система внутрішньоклітинного протеолізу задіяна в процесах проліферації, диференціації клітин, реакціях на стрес і патогени, неоплазії[2], репарації ДНК. Дефекти у цій складній системі можуть бути причиною порушень метаболізму, розвитку раку та нейродегенеративних захворювань, таких як хвороба Паркінсона.
1980 року Ірвін Роуз, Аврагам Гершко та Агарон Чехановер опублікували у PNAS статті, де йшлося про приєднання убіквітину до білків для їх напрямлення у протеасоми, для подальшого протеолізу. Дані про те, що внутрішньоклітинний протеоліз є АТФ-залежним, були вперше отримані Мелвіном Сімпсоном 1953 року. Це було незрозуміло, оскільки гідроліз пептидного зв'язку є екзергонічним процесом і не потребує енергії. Пізніше, коли в 1970-тих лабораторія Голдберга показала, що клітина швидко очищається від пошкоджених і ненормальних білків, а також, що білки, задіяні у внутрішньоклітинному сигналюванні, живуть недовго, стало зрозуміло, що для контролю протеолізу може бути потрібна енергія. У своїх роботах Гершко і Чехановер показали, що протеоліз може здійснюватись у безлізосомних лізатах клітин і для цього необхідна наявність двох фракцій: APF-1 (ATP-dependent proteolysis factor 1) низькомолекулярний білок, пізніше названий убіквітином, і APF-2 — високомолекулярна фракція, що стабілізувалась АТФ і являла собою, як з'ясувалось потім, активні протеасоми. Спочатку вони думали, що APF-2 — це кіназа, що фосфорилює APF-1 або якісь інші білки, що з ним взаємодіють. Вони інкубували мічену фракцію APF-1 з APF-2 в присутності АТФ, і виявилось, що APF-1 зв'язувався із білками у фракції APF-2, на велике здивування ковалентно. Було зрозуміло, що таке зв'язування необхідне для протеолізу, але залишалось неясно, чи APF-1 зв'язувався із субстратами чи ферментами протеолізу. Ковалентне зв'язування двох білків було явищем рідкісним, але не безпрецедентним, на той час було показано, що гістон Н2а може бути модифікований ковалентним приєднанням маленького білка — убіквітину. Аналіз показав, що APF-1 і є убіквітином. Пізніше було з'ясовано, що убіквітин є міткою для протеолізу білків, виявлені убіквітин-лігази, що забезпечували приєднання убіквітину до білків, ферменти «деубіквітинізації», інші білки, що можуть ковалентно модифікувати субстрати.
Гершко, Роуз і Чехановер за відкриття убіквітин-залежного протеолізу отримали Нобелівську премію з хімії 2004 року[3].
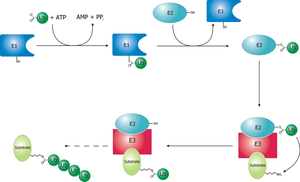
Деградація білка по убіквітиновому шляху включає два етапи: ковалентне приєднання поліубіквітинового ланцюжка і деградація білка 26S-протеасомою. Убіквітин — це пептид, що складається із 76 амінокислот. Його приєднання до білка проходить у три етапи за участі трьох груп ферментів: E1, E2 і Е3.[4][5]
- Фермент Е1 активує убіквітин, гідролізуючи АТФ. При цьому формується макроергічний зв'язок між С-кінцевим гліцином убіквітину і цистеїном Е1. Цей процес універсальний для будь-якого убіквітинового шляху, тому клітині достатньо одного варіанту Е1.
- Активований убіквітин переноситься на залишок цистеїну білка Е2 (UCP — ubiquitin carrier protein). Клітина містить кілька варіантів Е2 (наприклад, у дріжджів — 13). Кожен варіант може брати участь в обмеженій кількості убіквітинових шляхів, що визначається його здатністю взаємодіяти з одним або кількома типами Е3. Є молекули Е2, що можуть переносити убіквітин безпосередньо на білок без участі Е3.
- Білки класу Е3 — це убіквітин-лігази, здатні специфічно зв'язуватись із білковими субстратами, що підлягають протеолізу, прямо або через білок-помічник. Е3 каталізує утворення пептидного зв'язку між С-кінцем убіквітинової одиниці і аміногрупою лізинового залишку субстрату (якщо це перший убіквітин, що приєднується до субстрату) або лізину 48 попередньої молекули убіквітину. Е3 впізнають певний мотив у складі субстрату, що називається дегроном — на рівні Е3 забезпечується специфічність протеолізу. В клітині дуже багато варіантів Е3.
Убіквітин-лігази можуть впізнавати мотив, що констинутивно входить до складу білка. Наприклад N-кінцевий амінокислотний залишок. Але це ще не свідчить про те, що білок, який містить такий мотив, має деградувати. Зазвичай дегрон знаходиться поблизу частини молекули, що безпосередньо відповідає за виконання функцій білка, і якщо білок нормально скручений, дегрон недоступний для убіквітин-лігази. Також може відбуватись впізнавання білка, що був певним чином модифікований, наприклад — фосфорильований, або впізнавання субстрату в комплексі із відповідним адапторним білком.

Після приєднання убіквітину білок направляється у протеасому, де і здійснюється його протеоліз. Протеасоми містяться в цитоплазмі і ядрі клітини, але їх нема всередині органел. 26S-протеасома складається із серцевинного каталітичного комплексу 20S, з двох сторін якого знаходяться регулюючі субодиниці 19S. 20S-комплекс побудований із чотирьох кілець, кожне з яких складається із семи субодиниць, що кодуються 14 генами — 7 різних α-субодиниць і 7 різних β-субодиниць. В β-кільцях розміщені три каталітичні сайти:
- трипсин-схожий сайт — впізнає залишки тирозину і фенілаланіну
- хімотрипсин-схожий сайт — впізнає залишки лізину і аргініну
- сайт, що здійснює гідроліз ланцюга після залишку глутаміну.
Кожен сайт побудований із двох однакових субодиниць у різних кільцях. Крім цих трьох видів сайтів, що конститутивно входять до складу протеасоми, є ще такі, що можуть індукуватись лише в певних умовах. α-кільця необхідні для стабілізації β-кілець і для зв'язування з 19S-комплексами. 19S-комплекс володіє АТФазною властивістю і відповідає за впізнавання поліубіквітинових білків. 20S-циліндр може також зв'язуватись із 11S-комплексами, в такому випадку протеасома не зможе діяти на інтактні білки, але здатна здійснювати протеоліз коротких пептидів.
Деградація білків, асоційованих з мембраною, дещо відрізняється від протеолізу цитоплазматичних білків:
- відбувається у лізосомах
- для напрямлення білка в лізосому достатньо приєднання одного залишку убіквітину
- у випадку формування поліубіквітинового ланцюга зв'язування відбувається по 63 лізину.
Відщеплення потрібне для вивільнення убіквітину після гідролізу білка, для виправлення помилкового убіквітинування, крім того убіквітин синтезується у формі неактивного поліпопередника — його ще треба нарізати на функціональні молекули. Білки, що здійснюють відщеплення убіквітину, відносяться до тіолових протеїназ. Вони поділяються на два класи:
- С-кінцеві убіквітинові гідролази (UCH): здійснюють котрансляційний процесинг поліубіквітинового попередника, а також відщеплення убіквітину із комплексів із невеликими молекулярними масами — амінами і тіолами.
- Убіквітин-специфічні протеази (UBP) або ізопептидази — відщеплюють убіквітин від клітинних білків. У клітині є багато видів цих ферментів.
Убіквітин-залежний протеоліз є лише в еукаріот, хоча протеасоми є і прокаріот і у архей, але в них кепюча субодиниця відразу впізнає субстрат, таким чином число субстратів є сильно обмеженим. При убіквітинуванні число субстратів значно більше, внаслідок наявності великої кількості ферментів і можливості їх комбінування. Другою перевагою убіквітинування є те, що воно оборотнє. Для напрямлення білка у протеасому недостатньо одного залишку убіквітину, поки синтезується поліубіквітиновий ланцюг клітина має час «подумати». Таким чином забезпечується гнучкість системи протеолізу.
- ↑ Журнал здоров'я чоловіка №2 за 2011 рік ст.158. Архів оригіналу за 15 серпня 2015. Процитовано 15 серпня 2015. [Архівовано 2015-08-15 у Wayback Machine.]
- ↑ Журнал здоров'я чоловіка №2 за 2011 рік ст.159. Архів оригіналу за 15 серпня 2015. Процитовано 15 серпня 2015. [Архівовано 2015-08-15 у Wayback Machine.]
- ↑ Україно-ізраїльський центр науки освіти та кільтури. Архів оригіналу за 4 березня 2016. Процитовано 15 серпня 2015. [Архівовано 2016-03-04 у Wayback Machine.]
- ↑ Wang X, Herr RA, Chua WJ, Lybarger L, Wiertz EJ, Hansen TH (May 2007). Ubiquitination of serine, threonine, or lysine residues on the cytoplasmic tail can induce ERAD of MHC-I by viral E3 ligase mK3. J. Cell Biol. 177 (4): 613—24. doi:10.1083/jcb.200611063. PMC 2064207. PMID 17502423.
- ↑ Cadwell K, Coscoy L (July 2005). Ubiquitination on nonlysine residues by a viral E3 ubiquitin ligase. Science. 309 (5731): 127—30. doi:10.1126/science.1110340. PMID 15994556.
| Це незавершена стаття з молекулярної біології. Ви можете допомогти проєкту, виправивши або дописавши її. |
