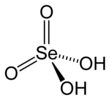
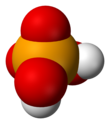
Asam selenat
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Asam selenat
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
| KEGG | |||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| H2SeO4 | |||
| Massa molar | 144.9734 g/mol | ||
| Penampilan | Kristal tidak berwarna | ||
| Densitas | 2.95 g/cm3, padat | ||
| Titik lebur | 58 °C (136 °F; 331 K) | ||
| Titik didih | 260 °C (500 °F; 533 K) (berdekomposisi) | ||
| 130 g/100 mL (30 °C) | |||
| Keasaman (pKa) | -3, 1.9[1] | ||
| −51.2·10−6 cm3/mol | |||
| Indeks bias (nD) | 1.5174 (D-line, 20 °C) | ||
| Struktur | |||
| tetrahedral at Se | |||
| Bahaya | |||
| Bahaya utama | Korosif, sangat beracun | ||
| Frasa-R | 23/25-33-50/53 | ||
| Frasa-S | 20/21-28-45-60-61 | ||
| Senyawa terkait | |||
Anion lain
|
asam selenit hidrogen selenida | ||
Kation lainnya
|
natrium selenat | ||
Senyawa terkait
|
Asam sulfat Selenium dioksida Selenium trioksida Asam telurat | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Asam selenat adalah senyawa anorganik dengan rumus H2SeO4. Rumus kimia yang dapat mendeskripsikan senyawa ini secara lebih akurat adalah (HO)2SeO2. Senyawa ini tidak berwarna. Walaupun tidak terlalu bermanfaat, natrium selenat yang berasal dari asam ini digunakan dalam proses produksi kaca dan makanan hewan.[2]
Struktur
[sunting | sunting sumber]Molekulnya berbentuk tetrahedral seperti yang diprediksi oleh teori VSEPR. Panjang ikatan Se–Onya tercatat sebesar 161 pm.[3] Dalam keadaan padat, senyawa ini mengalami kristalisasi menjadi struktur yang berbentuk ortorombik.[4]
Pembuatan
[sunting | sunting sumber]Asam ini dapat dibuat dengan mengoksidasi selenium dioksida dengan hidrogen peroksida:
- SeO2 + H2O2 → H2SeO4
Tidak seperti proses produksi asam sulfat dengan memasukkan sulfur trioksida ke dalam air, hidrasi selenium trioksida bukanlah metode yang praktis.[3] Asam selenat malah lebih mudah disiapkan dengan mengoksidasi asam selenit (H2SeO3) dengan halogen seperti klor atau brom atau dengan kalium permanganat.[5] Namun, penggunaan klor atau brom akan menghasilkan asam klorida atau bromida sebagai produk sampingan yang perlu dikeluarkan dari larutan karena dapat mereduksi asam selenat menjadi asam selenit.[6]
Metode lain adalah dengan mengoksidasi unsur selenium dengan air dan klor:[5]
- Se + 4 H2O + 3 Cl2 → H2SeO4 + 6 HCl
Untuk memperoleh asam anhidrat dalam bentuk kristal padat, larutan diuapkan dengan suhu di atas 140 °C (413 K; 284 °F) dalam keadaan hampa udara.[7]
Reaksi
[sunting | sunting sumber]Layaknya asam sulfat, asam selenat merupakan asam kuat yang bersifat higroskopik dan sangat mudah larut dalam air. Larutan yang terkonsentrasi berbentuk kental. Terdapat monohidrat dan dihidrat kristalin asam selenat yang telah ditemukan.[5] Monohidratnya meleleh pada suhu 26 °C, dan dihidratnya meleleh pada suhu −51.7 °C.[3]
Asam selenat merupakan oksidator yang lebih kuat daripada asam sulfat[5] dan mampu membebaskan klor dari ion klorida, dan dalam prosesnya asam ini mengalami reduksi menjadi asam selenit:
- H2SeO4 + 2 H+ + 2 Cl− → H2SeO3 + H2O + Cl2
Asam ini mengalami dekomposisi di atas suhu 200 °C; dalam prosesnya, asam ini mengalami reduksi menjadi asam selenit dan juga mengeluarkan gas oksigen:[5]
- 2 H2SeO4 → 2 H2SeO3 + O2
Jika direaksikan dengan asam fluorosulfat, hasilnya adalah selenoil fluorida:[7]
- H2SeO4 + 2 HO3SF → SeO2F2 + 2 H2SO4
Asam selenat yang panas dan terkonsentrasi dapat bereaksi dengan emas dan menghasilkan larutan emas(III) selenat yang berwarna kuning-kemerahan:[8]
- 2 Au + 6 H2SeO4 → Au2(SeO4)3 + 3 H2SeO3 + 3 H2O
Referensi
[sunting | sunting sumber]- ^ https://books.google.com/books?id=30dGrYYa-zkC&pg=PA66&lpg=PA66&dq=%22selenic+acid%22+pka&source=bl&ots=gm5ce_td22&sig=ILeuRWYbEUtIcVRm_rcZjK20La8&hl=en&sa=X&ei=TVsvVfqjGMGiugTJzIGgCw&ved=0CFkQ6AEwCQ#v=onepage&q=%22selenic%20acid%22%20pka&f=false
- ^ Bernd E. Langner "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a23_525.
- ^ a b c Don M. Yost (2007). Systematic Inorganic Chemistry. READ BOOKS. hlm. 343–346. ISBN 1-4067-7302-6.
- ^ Mathias S. Wickleder (2007). Francesco A. Devillanova, ed. Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. hlm. 353. ISBN 0-85404-366-7.
- ^ a b c d e Anil Kumar De (2003). A Text Book of Inorganic Chemistry. New Age International. hlm. 543–545. ISBN 81-224-1384-6.
- ^ Lenher, V.; Kao, C. H. (June 1925). "The preparation of selenic acid and of certain selenates". Journal of the American Chemical Society. 47 (6): 1521–1522. doi:10.1021/ja01683a005.
- ^ a b Seppelt, K. “Selenoyl difluoride” Inorganic Syntheses, 1980, volume XX, pp. 36-38. ISBN 0-471-07715-1. The report describes the synthesis of selenic acid.
- ^ Lenher, V. (April 1902). "Action of selenic acid on gold". Journal of the American Chemical Society. 24 (4): 354–355. doi:10.1021/ja02018a005.