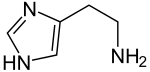
Histamin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Histamin | |||||||||||||||||||||
| Andere Namen |
2-(1H-Imidazol-4-yl)ethanamin (IUPAC) | |||||||||||||||||||||
| Summenformel | C5H9N3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, hygroskopischer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 111,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Löslichkeit |
leicht löslich in Wasser und Ethanol, unlöslich in Diethylether[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Histamin (von altgriechisch ἱστός histos „Gewebe“) – in der Nomenklatur: 2-(4-Imidazolyl)ethylamin – ist ein auch synthetisch herstellbarer Naturstoff, der im menschlichen oder tierischen Organismus als Gewebshormon und Neurotransmitter wirkt und auch im Pflanzenreich und in Bakterien weit verbreitet ist. Beim Menschen und anderen Säugetieren spielt Histamin eine zentrale Rolle bei allergischen Reaktionen und ist am Immunsystem, d. h. an der Abwehr körperfremder Stoffe, beteiligt. So dient es als einer der Botenstoffe in der Entzündungsreaktion, um eine Anschwellung des Gewebes zu bewirken. Auch im Magen-Darm-Trakt, bei der Regulation der Magensäureproduktion und der Motilität sowie im Zentralnervensystem bei der Steuerung des Schlaf-Wach-Rhythmus und der Appetitkontrolle wirkt Histamin als wichtiger Regulator. Biochemisch ist es, wie auch Tyramin, Serotonin, Dopamin, Adrenalin, Noradrenalin oder Octopamin, ein biogenes Amin. Es wird durch Abspaltung von Kohlenstoffdioxid (Decarboxylierung) aus der Aminosäure Histidin gebildet und insbesondere in Mastzellen, basophilen Granulozyten und Nervenzellen gespeichert.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Geschichte der Erforschung des Histamins begann im Jahr 1907 mit seiner Synthese als chemische Kuriosität durch die deutschen Chemiker Adolf Windaus und W. Vogt.[6] Bereits drei Jahre später gelang Henry H. Dale und George Barger der Nachweis von Histamin im Mutterkorn und somit die Entdeckung von Histamin als Naturstoff.[7] Im gleichen Jahr wiesen Henry H. Dale und P. P. Laidlaw Histamin als körpereigene Substanz nach. Dale und Laidlaw klärten gleichzeitig einige grundlegende Funktionen des Histamins auf.[8] Die Biosynthese des Histamins aus der Aminosäure Histidin konnte durch Dankwart Ackermann ebenfalls 1910 aufgeklärt werden.[9]
Daniel Bovet und Anne-Marie Staub entdeckten im Jahr 1937 erste Substanzen, die die Wirkung von Histamin hemmen (Antihistaminika).[10] Bereits fünf Jahre später wurden mit Phenbenzamin und Mepyramin die ersten Antihistaminika in der Therapie eingesetzt. Anfang der 1950er Jahre wurden von der französischen Pharmafirma Rhône-Poulenc im Rahmen der Anti-Histaminforschung die ersten Neuroleptika entwickelt.[11] Im Jahr 1972 gelang James W. Black und Mitarbeitern die Unterscheidung zwischen H1- und H2-Rezeptoren.[12] Als weitere Subtypen des Histaminrezeptors wurden 1983 der H3-Rezeptor durch Jean-Michel Arrang mit Hilfe pharmakologischer Methoden[13] und 2000 der H4-Rezeptor durch Entschlüsselung des menschlichen Genoms[14] entdeckt.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]
Histamin bildet farblose, hygroskopische, bei 84 °C schmelzende Kristalle, die sich leicht in Wasser und Ethanol lösen, nicht jedoch in Diethylether. Die Verbindung liegt in wässriger Lösung als Gemisch zweier Tautomere, Nπ-H-Histamin und Nτ-H-Histamin, vor.
Histamin besitzt zwei basische Zentren, d. h. zwei Atomgruppen mit Stickstoffatomen, an die Protonen angelagert werden können. Unter physiologischen Bedingungen wird bevorzugt die aliphatische Nα-Aminogruppe mit ihrem pKa-Wert von 9,4 protoniert, während der Imidazolring (pKa = 5,8) erst in einem stärker sauren Milieu ein Proton aufnimmt.[15]
Biosynthese
[Bearbeiten | Quelltext bearbeiten]
Histamin wird in Mastzellen, Zellen der Epidermis und der Magenschleimhaut und in Nervenzellen synthetisiert und in Vesikeln gespeichert. In diesen Zellen wird Histamin aus der Aminosäure Histidin durch eine Pyridoxalphosphat-abhängige Decarboxylierung mittels des Enzyms Histidindecarboxylase in einer Ein-Schritt-Reaktion gebildet. In geringerem Ausmaß kann auch die unspezifische Aromatische-L-Aminosäure-Decarboxylase an der Biosynthese des Histamins beteiligt sein.
Abbau
[Bearbeiten | Quelltext bearbeiten]
Histamin wird im Körper über zwei verschiedene Wege abgebaut. Insbesondere im Zentralnervensystem erfolgt eine Inaktivierung zum Nτ-Methylhistamin durch das Enzym Histamin-N-Methyltransferase. Nτ-Methylhistamin wird nachfolgend oxidativ über Monoaminooxidasen, Diaminoxidasen und Aldehydoxidasen zur Nτ-Methylimidazolylessigsäure abgebaut.[16] In der Peripherie hingegen spielt die Histaminmethylierung eine untergeordnete Rolle. Hier erfolgt der Abbau vorwiegend über Diaminoxidasen und Aldehydoxidasen zur Imidazolylessigsäure. Diese wird nach Ribosylierung über die Nieren ausgeschieden.
Speicherung und Freisetzung
[Bearbeiten | Quelltext bearbeiten]
Histamin kommt in erhöhter Konzentration in den Mastzellen, den basophilen Granulozyten sowie in histaminspeichernden Zellen der Schleimhäute, der Bronchien und des Magen-Darm-Trakts vor. In diesen Zellen wird Histamin in Vesikeln an Heparin gebunden gespeichert. Aus diesen Vesikeln wird Histamin bei IgE-vermittelten allergischen Reaktionen vom „Soforttyp“ (Typ I) oder durch Komplementfaktoren (z. B. bei einem Endotoxin-bedingten Schock) freigesetzt. Neben Gewebshormonen können auch Arzneistoffe, wie beispielsweise Opiate, Muskelrelaxantien sowie Plasmaexpander und Röntgenkontrastmittel, eine Freisetzung von Histamin hervorrufen. Ein weiterer wichtiger Speicherort von Histamin sind die ECL-Zellen der Magenschleimhaut, aus denen Histamin durch Hormone und Gewebshormone, wie z. B. Gastrin, Acetylcholin und PACAP (pituitary adenylate cyclase activating polypeptide) freigesetzt werden kann.
Erhöhte Histaminkonzentrationen können auch in Teilen des Zentralnervensystems und der Gehirn-Rückenmarks-Flüssigkeit (Liquor cerebrospinalis) nachgewiesen werden. Die höchste Histaminkonzentration kann dabei im Hypothalamus gefunden werden. Innerhalb des Zentralnervensystems fungiert Histamin auch als Neurotransmitter in histaminergen Neuronen. Eine Freisetzung von Histamin in den synaptischen Spalt wird durch Acetylcholin, Noradrenalin und Histamin selbst über präsynaptische Rezeptoren gehemmt.
Funktion
[Bearbeiten | Quelltext bearbeiten]Im menschlichen Organismus besitzt Histamin vielfältige Funktionen, wobei seine Beteiligung an Abwehrreaktionen im Vordergrund steht. Auf molekularer Ebene vermittelt Histamin seine Funktionen über eine Aktivierung der Histamin-Rezeptoren H1, H2, H3 und H4, die zur Familie der G-Protein-gekoppelten Rezeptoren gehören.
Abwehrreaktionen
[Bearbeiten | Quelltext bearbeiten]Wichtige Mitwirkungen des Histamins sind seine Funktion an der Abwehr körperfremder Stoffe und seine pathologische Beteiligung an der Symptomatik von Allergien und Asthma. Ebenso ist Histamin eine der Mediatorsubstanzen bei Entzündungen und Verbrennungen. Hierbei führt Histamin zu Jucken, Schmerz und Kontraktion der glatten Muskulatur (beispielsweise in den Bronchien). Es bewirkt eine erhöhte Permeabilität der Gefäßwände kleiner Blutgefäße und führt so zur Nesselsucht. An diesem Prozess ist auch eine durch Histamin induzierte Aktivierung des Transkriptionsfaktors NF-κB und eine damit verbundene vermehrte Freisetzung weiterer Entzündungsmediatoren beteiligt.[17] Histamin führt ebenfalls zu einer Freisetzung von Adrenalin aus den Nebennieren. Diese Effekte werden insbesondere über eine Aktivierung von H1-Rezeptoren vermittelt.
Histamin wirkt chemotaktisch auf verschiedene, an der Abwehr körperfremder Stoffe beteiligte Zellen, beispielsweise die eosinophilen Granulozyten und die T-Zellen. Für diese Effekte wird vor allem eine Aktivierung von H4-Rezeptoren verantwortlich gemacht.[18]
Anders als beim Menschen spielt Histamin bei Hunden und Katzen bei der Entstehung von Juckreiz nur eine untergeordnete Rolle.
Magen-Darm-Trakt
[Bearbeiten | Quelltext bearbeiten]Im Magen-Darm-Trakt ist Histamin an der Regulation der Magensäureproduktion und (über seine erregende Wirkung auf die glatte Muskulatur) der Motilität beteiligt. Die durch Histamin über eine Aktivierung von H2-Rezeptoren vermittelte Steigerung der Magensäureproduktion kann dabei als ein Bestandteil einer Histamin-vermittelten Abwehrreaktion interpretiert werden.
Herz-Kreislaufsystem
[Bearbeiten | Quelltext bearbeiten]Ebenfalls als Bestandteil einer Abwehrreaktion kann die Wirkung von Histamin auf die Blutgefäße interpretiert werden. Es kontrahiert H1-Rezeptor-vermittelt die großen Blutgefäße (Durchmesser von mehr als 80 µm) und führt zu einer Erweiterung kleinerer Blutgefäße verbunden mit Hautrötung.[19] Am Herzen besitzt Histamin über eine Aktivierung von H2-Rezeptoren eine positiv inotrope (die Schlagkraft steigernde) und positiv chronotrope (die Schlagfrequenz steigernde) Wirkung.
Zentralnervensystem
[Bearbeiten | Quelltext bearbeiten]Im Zentralnervensystem ist Histamin über eine Aktivierung von H1-Rezeptoren an der Auslösung des Erbrechens sowie der Regulation des Schlaf-Wach-Rhythmus beteiligt. Basierend auf tierexperimentellen Befunden wird eine antidepressive, antikonvulsive und appetitzügelnde Wirkung des Histamins diskutiert. Ebenso scheint es an der Regulation der Körpertemperatur, der zentralen Kontrolle des Blutdrucks und der Schmerzempfindung beteiligt zu sein.[20] Über präsynaptische Rezeptoren (insbesondere H3-Rezeptoren) besitzt Histamin durch Hemmung der Neurotransmitterfreisetzung im Zentralnervensystem und im peripheren Nervensystem einen regulatorischen Einfluss auf noradrenerge, serotoninerge, cholinerge, dopaminerge und glutaminerge Neuronen. Histamin beeinflusst somit indirekt die Wirkung dieser Neurotransmitter.
Aktuell laufen Studien in Europa mit Histamin als Arzneistoff mit wachmachender (vigilanzsteigernder) Wirkung. Zum Einsatz könnte das Medikament in einiger Zeit z. B. bei krankhaften Schlaf-Wach-Regulationsstörungen kommen.
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Die Verträglichkeitsgrenze von Histamin liegt bei erwachsenen Primaten ungefähr bei 10 mg. Größere Mengen Histamin führen zu einer Vergiftung, die durch akute Beschwerden wie Atemnot, Blutdruckabfall, Rötung der Haut, Nesselausschlag, Übelkeit, Erbrechen, Kopfschmerzen und Durchfall gekennzeichnet ist. Eine Menge von 100 mg Histamin führt bereits zu deutlichen Vergiftungserscheinungen. Die Verträglichkeitsgrenze könnte bei Patienten mit einer Histamin-Intoleranz deutlich herabgesetzt sein. Die Einnahme größerer Mengen an histaminhaltigen Nahrungsmitteln, z. B. bei einer bestimmten Form der Fischvergiftung[21] kann dementsprechend ebenso zu Vergiftungssymptomen führen wie die gleichzeitige Einnahme von MAO-Hemmern und tyramin- oder histaminhaltigen Lebensmitteln wie Fisch, Fleisch, Käse, Gemüse und Wein.[22]
Im Tierversuch zeigte Histamin bei verschiedenen Tierarten (Hund, Maus, Meerschweinchen, Ratte, Hase) negative Effekte auf die Lunge und das gesamte Atmungssystem.[5][4] Bei Hunden führten intravenöse Gaben von 7 mg/kg zu Störungen bei der Herzfunktion,[23] subkutane Dosen führten ab 28,5 mg/kg zu Durchfall und Koma.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Histamin wird zur medizinischen Diagnostik, v. a. von Atopien und Allergien, sowie im inhalativen Provokationstest und zur Positivkontrolle beim Intrakutantest eingesetzt. Darüber hinaus werden auch Arzneistoffe, welche die Freisetzung von Histamin aus Mastzellen (Mastzellstabilisatoren) oder die Wirkung von Histamin an Histaminrezeptoren blockieren (Antihistaminika), in der Therapie verwendet. Mit Mastzellenstabilisatoren (beispielsweise Cromoglicinsäure (DNCG), Nedocromil oder Lodoxamid) und mit H1-Antihistaminika (z. B. Diphenhydramin, Loratadin oder Cetirizin) werden allergische Beschwerden symptomatisch behandelt. Außerdem werden Schlafstörungen, Angststörungenen, Übelkeit und Erbrechen mit H1-Antihistaminika behandelt. H2-Antihistaminika (wie Cimetidin, Ranitidin oder Famotidin) sind als Hemmer der Magensäureproduktion bedeutende Antazida.
Ein Analogon des Histamins ist das vasodilatatorische Betahistin, welches als Antiemetikum und Antivertiginosum (also gegen Schwindel) v. a. bei Morbus Menière und Hydrops cochleae eingesetzt wird.
Verwendung als Arzneimittel
[Bearbeiten | Quelltext bearbeiten]Histamin wird unter dem Handelsnamen Ceplene in der Krebsimmuntherapie als Injektionslösung in Kombination mit Interleukin-2 als Arzneistoff zur Behandlung akuter myeloischer Leukämie (AML) eingesetzt, einer seltenen Krebserkrankung, von der die weißen Blutkörperchen betroffen sind. Da nur wenige Patienten unter dieser Krebsform leiden, wurde Ceplene 2005 als Arzneimittel für seltene Leiden („Orphan-Arzneimittel“) ausgewiesen. Die arzneimittelrechtliche Zulassung folgte 2008.[24]
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete (Indikationen)
[Bearbeiten | Quelltext bearbeiten]Histamin ist zur Behandlung der akuten myeloischen Leukämie in Kombination mit Interleukin-2 bei Krebspatienten in der ersten Remission zugelassen. Die Zulassung beschränkt sich auf erwachsene Patienten, wobei eine Wirksamkeit bei Patienten über 60 Jahre nicht vollständig nachgewiesen wurde.[25]
Gegenanzeigen (Kontraindikationen)
[Bearbeiten | Quelltext bearbeiten]Als absolute Kontraindikation für die Anwendung von Histamin in der Krebsimmuntherapie gelten Überempfindlichkeitsreaktionen, mittelschwere und schwere Herzinsuffizienz (NYHA III und IV) sowie die gleichzeitige systemische Anwendung von Steroiden, des Blutdrucksenkers Clonidin oder magensäuresekretionshemmender Arzneimittel aus der Gruppe der H2-Antihistaminika. Ebenso ist die Krebsimmuntherapie mit Histamin und Interleukin-2 bei Patienten mit einer allogenen Stammzelltransplantation kontraindiziert. Da in präklinischen Studien an Nagetieren nach einer Anwendung von Histamin Hinweise auf schädigende Wirkungen auf die Nachkommen gefunden wurden, ist die Anwendung bei Schwangeren und Stillenden kontraindiziert.[25]
Histamin als Abwehrstoff
[Bearbeiten | Quelltext bearbeiten]
Histamin wird in einigen Pflanzen und Tieren auch als Abwehrsubstanz produziert und gespeichert. Beispielsweise speichert die Große Brennnessel in ihren Brennhaaren neben anderen Substanzen Histamin, das bei Berührung abgegeben wird.[27] Die Kegelkopfschrecke Poekilocerus bufonius gibt bei Gefahr ein Sekret ab, das neben Cardenoliden ca. 1 % Histamin enthält.[28] Histamin ist auch im Hautdrüsensekret der Südfrösche enthalten.[29] Darüber hinaus können tierische und pflanzliche Abwehrstoffe, wie beispielsweise das Mastzelldegranulierende Peptid (MCD-Peptid) des Bienengifts, Histamin aus den Mastzellen höherer Tiere freisetzen und somit eine Entzündungsreaktion auslösen.[30]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Stephen J. Hill et al.: International Union of Pharmacology. XIII. Classification of histamine receptors. In: Pharmacological Reviews. Band 49, Nr. 3, September 1997, S. 253–278, PMID 9311023 (englisch).
- S1-Leitlinie Vorgehen bei Verdacht auf Unverträglichkeit gegenüber oral aufgenommenem Histamin der Deutschen Gesellschaft für Allergologie und klinische Immunologie (DGAKI). In: AWMF online (Stand 2021)
- Peter Dilg: Histamin. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 604 f.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Histamine, Free Base (PDF) bei Calbiochem, abgerufen am 8. Dezember 2015.
- ↑ a b c Datenblatt Histamine bei Sigma-Aldrich, abgerufen am 4. April 2011 (PDF).
- ↑ Eintrag zu Histamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juni 2014.
- ↑ a b c d D. Bovet, F. Bovet-Nitti: Structure et Activite Pharmacodyanmique des Medicaments du Systeme Nerveux Vegetatif. S. Karger, New York 1948, S. 718.
- ↑ a b Japanese Journal of Toxicology. Vol. 4, 1991, S. 105.
- ↑ A. Windaus, W. Vogt: Synthese des Imidazoläthylamins. In: Chemische Berichte. Band 40, 1907, S. 3691.
- ↑ G. Barger, H. H. Dale: Journal of the Chemical Society. Band 97, S. 466–473.
- ↑ H. H. Dale, P. P. Laidlaw: The physiological action of β-Imidazolethylamine. In: The Journal of Physiology. Band 41, 1910, S. 318–344.
- ↑ D. Ackermann: Zeitschrift für Physiol. Chem. Band 60, 1910, S. 482–501.
- ↑ D. Bovet, A. Staub: Action protectrice des éthers phenoliques au cours l’intoxication histaminique. In: Comptes Rendus des Séances et Mémoires de la Société de Biologie. Band 124, 1937, S. 547–549.
- ↑ Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4, S. 74–77.
- ↑ J. W. Black, W. A. M. Duncan, C. J. Durant, C. R. Ganellin, M. E. Parsons: Definition and antagonism of histamine H2 receptors. In: Nature. Band 236, 1972, S. 385–390.
- ↑ J. M. Arrang, M. Garbarg, J. C. Schwartz: Auto-inhibition of brain histamine release mediated by a novel class (H3) of histamine receptor. In: Nature. Band 302, 1983, S. 832–837.
- ↑ T. Nakamura, H. Itadani, Y. Hidaka, M. Ohta, K. Tanaka: Molecular cloning and characterization of a new human histamine receptor, HH4R. In: Biochem. Biophys. Res. Commun. Band 279, 2000, S. 615–620.
- ↑ T. B. Paiva, M. Tominaga, A. C. Paiva: Ionization of histamine, N-acetylhistamine, and their iodinated derivatives. In: Journal of Medicinal Chemistry. Band 13, Nr. 4, Juli 1970, S. 689–692, doi:10.1021/jm00298a025, PMID 5452432 (englisch).
- ↑ J.-C. Schwartz, J.-M. Arrang, M. Garbarg, H. Pollard, M. Ruat: Histaminergic transmission in the mammalian brain. In: Physiol. Rev. 71, 1991, S. 1–51. PMID 1846044.
- ↑ J. P. Rihoux et al.: Hypothetical mechanisms of action of an H1-antihistamine in asthma. In: International Archives of Allergy and Immunology. Band 118, Nr. 2-4, 1999, S. 380–383, doi:10.1159/000024142, PMID 10224453 (englisch).
- ↑ M. Zhang, J. D. Venable, R. L. Thurmond: The histamine H4 receptor in autoimmune disease. In: Expert. Opin. Investig. Drugs. 15, 2006, S. 1443–1452. PMID 17040202.
- ↑ I. Marshall: Characterization and distribution of histamine H1- and H2-receptors in precapillary vessels. In: J Cardiovasc Pharmacol. 6 Suppl 4, 1984, S. S587–S597, PMID 6083401.
- ↑ H. H. Pertz, S. Elz, W. Schunack: Structure-activity relationship of histamine H1-receptor agonists. In: Mini-Rev Med Chem. 4, 2004, S. 935–940.
- ↑ Pierina Visciano et al.: Histamine poisoning and control measures in fish and fishery products. In: Frontiers in Microbiology. Band 5, 23. September 2014, doi:10.3389/fmicb.2014.00500, PMID 25295035, PMC 4172148 (freier Volltext) – (englisch).
- ↑ Aishath Naila et al.: Control of Biogenic Amines in Food-Existing and Emerging Approaches. In: Journal of Food Science. Band 75, Nr. 7, September 2010, S. R139–R150, doi:10.1111/j.1750-3841.2010.01774.x, PMID 21535566, PMC 2995314 (freier Volltext) – (englisch).
- ↑ Indian Veterinary Journal. Vol. 57, 1980, S. 31.
- ↑ Ceplene: Zusammenfassung der Merkmale des Arzneimittels. (PDF; 641 kB) auf der Website der Europäischen Arzneimittelagentur EMEA, Stand: 7. Oktober 2008.
- ↑ a b Fachinformation Ceplene. (PDF) In: EMA. Abgerufen am 10. Februar 2023.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich, 2006, ISBN 3-906390-29-2, S. 247.
- ↑ F. Oliver et al.: Contact urticaria due to the common stinging nettle (Urtica dioica)--histological, ultrastructural and pharmacological studies. In: Clinical and Experimental Dermatology. Band 16, Nr. 1, Januar 1991, S. 1–7, doi:10.1111/j.1365-2230.1991.tb00282.x, PMID 2025924 (englisch).
- ↑ Dieter Schlee: Ökologische Biochemie. Gustav Fischer, Jena 1992, ISBN 3-334-60393-8, S. 404f.
- ↑ Dieter Schlee: Ökologische Biochemie. Gustav Fischer, Jena 1992, ISBN 3-334-60393-8, S. 421.
- ↑ Dieter Schlee: Ökologische Biochemie. Gustav Fischer, Jena 1992, ISBN 3-334-60393-8, S. 409.

