Atom
| Geliy atomi | ||||||||
|---|---|---|---|---|---|---|---|---|
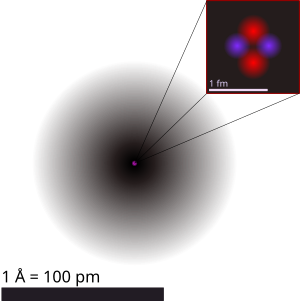 | ||||||||
| Geliy atomi illustratsiyasi, unda yadro (pushti) va elektron buluti tarqalishi (qora) tasvirlangan. Geliy-4 yadrosi (tepada oʻngda) sferik simmetrik boʻlib, elektron bulutiga oʻxshaydi, biroq murakkab yadrolar bunday boʻlmasligi mumkin. Qora chiziq uzunligi — bir angstrom (10−10 m yoki 100 pm). | ||||||||
| Tasnifi | ||||||||
| ||||||||
| Xossalari | ||||||||
|
Atom (qadimgi yunoncha: ἄτομος — atomos — boʻlinmas) — kimyoviy elementning barcha xossalarini oʻzida mujassamlashtirgan eng kichik zarrasi. Dastlabki „boʻlinmas“ nomini olgan bu zarraning ichki tuzilishi anchagina murakkab. Atom musbat zaryadlangan negiz (yadro) va yadro atrofida harakatlanuvchi elektronlardan tashkil topgan. Atom markazida barcha massasi jamlangan musbat zaryadlangan negiz (yadro) joylashgan; atrofida oʻlchovlari (~ 10~8 sm) atom oʻlchovlarini ifodalaydigan elektron qobiqlarini hosil qiluvchi elektronlar harakat qiladi. Atom yadrosi protonlar va neytronlardan tashkil topgan. Atomdagi elektronlar soni yadrodagi protonlar soniga teng (atomdagi barcha elektronlar zaryadi yadro zaryadiga teng), protonlar soni elementning davriy tizimidagi tartib raqamiga teng. Atom elektronlarni tutib olib yoki berib, manfiy yoki musbat zaryadlangan ionlarga aylanadi. Atomning kimyoviy xossalari asosan tashqi qobiqdagi elektronlar soni bilan aniqlanadi; kimyoviy qoʻshilib, atomlar molekulalar hosil qiladi. Atomning ichki energiyasi uning muhim koʻrsatkichi hisoblanadi. Ichki energiya maʼlum (diskret) qiymatlarga ega boʻlishi va u sakrashsimon kvant oʻtishlardagina oʻzgarishi mumkin. Maʼlum qiymatdagi energiyani yutib, atom qoʻzgʻalgan holat (energiyaning yuqoriroq sathi)ga oʻtadi. Atom foton chiqarib, qoʻzgʻalgan holatdan kichik energiyali holat (energiyaning pastroq sathi)ga oʻtadi. Atomning eng kichik energiyasiga mos sathi asosiy sath, Atom markazida Ze musbat zaryadli massiv yadro joylashgan, yadro atrofida — Ze elektronlar aylanadi. Atomning deyarli hamma massasi yadroda toʻplangan. qolganlari esa qoʻzgʻalgan sathlar deyiladi.atom tuzilishi haqidagi fan („Atom fizikasi“ „Yadro fizikasi“, „Elementar zarralar fizikasi“ va boshqa yoʻnalishlar) nazariyasi ancha murakkab boʻlib, fizikaning deyarli barcha yutuqlariga va hozirgi zamon matematik apparat yutuqlariga tayanadi[1].
Atamani yunon faylasufi Demokrit miloddan avvalgi V asrda kiritgan.
- Hamma jismlar, shu jumladan oʻzimiz ham, atomlar deb ataluvchi juda mayda „gʻishtchalar“ dan iborat. Tabiatda kimyoviy elementlar qancha boʻlsa, bunday „gʻishtchalar“ turlari shuncha boʻladi. Kimyoviy element — ayni bir turdagi atomlar toʻplami.
Atom atamasining kelib chiqishi
[edit | edit source]Modda juda mayda zarrachalardan tuzilganligi haqidagi fikr qadimgi yunon olimlari tomonidanoq aytilgan edi. Ular ana shu zarrachalarni atomlar deb atashdi. Qadimgi yunonlar atomlar muntazam koʻpyoqliklar shakliga ega, deb faraz qilganlar: Kub („Yer atomlari“), Tetraedr („Olov atomlari“), Oktaedr (Havo atomlari), Ikosaedr („suv atomlari“). Moddaning atomlardan tuzilganligi gʻoyasining eksperimental isboti olingunga qadar yigirma asrdan ortiq vaqt oʻtdi. Bu gʻoya fanda kimyo va kinetik nazariyaning yutuqlari tufayli XIX asrning ikkinchi yarmida qatʼiy qaror topdi. XX asr boshiga kelib, fiziklar atomlarning oʻlchamlari 10 −10 m va massasi 10 −27 kg atrofida boʻlishini bilar edilar. Bu vaqtga kelib atomlar umuman „boʻlinmas“ emas, ular maʼlum ichki tuzilishiga ega, buni bilish esa D. I. Mendeleyev aniqlagan kimyoviy elementlar hossalarining davriyligini tushuntirishga imkon berishi aniq boʻlib qoldi.
Tomson atomi modeli
[edit | edit source]
Elektron kashf etilgandan bir oz vaqt oʻtgandan keyin, 1903-yilda ingliz fizigi Jozef Jon Tomson diametri tahminan 10 −10 m, ichiga elektronlar „sochilgan“, hajmi boʻyicha musbat zaryadlangan sfera shaklidagi atom modelini taklif etdi. Elektronlarning sfera markaziga nisbatan tebranganda, atom yorugʻlik nurlantiradi. Tosmon, elektronlar sfera markazi atrofida qatlam boʻlib guruhlanadi, deb hisobladi.
Rezerford tajribasi
[edit | edit source]Tomson taklif etgan modelda atom massasi uning hajmi boʻyicha bir tekis taqsimlangan. Bunday farazning hato ekanligini tez orada ingliz fizigi Ernest Rezerford isbotladi. 1908-1911-yillarda uning rahbarligida α-zarralar (geliy yadrolari)ning metal folga (zar qogʻoz)da sochilishiga oid tajribalar oʻtkazilgan edi. (qarang Alfa yemirilish). α-zarra yupqa folgadan (qalinligi 1 mkm) oʻtib va oltingugurtli qoʻrgʻoshindan qilingan ekranga tushib, mikroskopda yaxshi koʻrinadigan chaqnashni vujudga keltirar ekan. Ekranni α-zarraning dastlabki harakat yoʻnalishida xar hil burchaklarda joylashtirildi va folgadan u yoki bu burchakka sochilgan zarralar soni sanaldi. Koʻpchilik zarralar folgadan bir oz ogʻib oʻtib ketishi aniqlandi, biroq ayrim hollarda (tahminan 10 000 lan bittasida) α-zarraning 90˚ dan katta burchakka ogʻgani kuzatildi.

Bu, agar 15 duymli snaryadni bir varaq papiros qogʻoziga otganingizda, snaryad qogʻozdan qaytib kelib, sizga tekkanidek, aql bovar qilmaydigan hol edi
— deb keyinchalik eslagan edi Rezerford. α-zarrachalarning sochilishiga oid tajribalar shuni yaqqol koʻrsatdiki, atomning butun massasi juda kichik hajmda — atom yadrosida toʻplangan boʻlib, uning diametri atom diametridan 10 000 marta kichikdir. Koʻpchilik α-zarralar ogʻir yadro yonidan, unga tegib ketmasdan uchib oʻtadi, biroq bunda u orqaga „sakrab ketishi“ mumkin.
Rezerford tajribalari atomning yadro modeli ni yaratish uchun asos boʻldi. Bu model bizning atom tuzilishi haqidagi bugungi tasavvurlarimizni ifodalaydi.
Atom tuzilishi
[edit | edit source]Atom markazida atom yadrosi joylashgan, atomning qolgan hamma hajmini elektronlar egallaydi. Yardo ichida elektronlar yoʻq (bu 1930-yillar boshida aniq boʻldi); yadro musbat zaryadlangan protonlar va zaryadga ega boʻlmagan neytronlardan iborat. Atomdagi elektronlar soni yadrodagi protonlar soniga teng; bu mazkur kimyoviy elementning atom raqami (uning davriy sistemadagi tartib raqami) dir. Elektron massasi proton yoki neytron massasidan tahminan 2000 marta kichik, shuning uchun atomning hamma massasi yadroga toʻplangan. Turli elektronlar yadro bilan turli darajada bogʻlangan; ularning baʼzilarini atom nisbatan oson yoʻqotishi mumkin, bunda u musbat ionga aylanadi. Atom qoʻshimcha elektronlarga ega boʻlib, manfiy ionga aylanadi. Atomning birinchi miqdoriy nazariyasini 1913-yilda daniya fizigi Nils Bor ishlab chiqdi. Bu eng oddiy atom — vodorod atomining nazariyasi edi. Nils Bor Rezerford tajribalarining natijalaridan va oʻsha vaqtlarda maʼlum boʻlgan atomlar vodorodning spektri haqidagi maʼlumotlardan foydalandi. U vodorod atomini quyidagi koʻrinishda tasavvur qildi: proton (atom yadrosi) atrofida aylanma orbita boʻlib elektron harakatlanadi.
Yana qarang
[edit | edit source]Foydalanilgan adabiyotlar
[edit | edit source]- Abdurazzoqov atom Atom, Nazirov E. N., Rasulova M. Y.. Yosh Fizik ensikloperik Lugʻati, 1989-yil.
Manbalar
[edit | edit source]| Ushbu maqolada Oʻzbekiston milliy ensiklopediyasi (2000-2005) maʼlumotlaridan foydalanilgan. |
