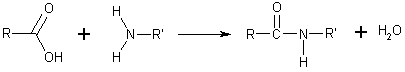Amid

Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.
Birinci anlamıyla amid, bir amin türevidir. Genelde R1(CO)NR2R3 formülü ile gösterilir, burada R2 ve R3'ten biri veya ikisi birden hidrojen olabilir. Başka bir bakış açısıyla amidler bir karboksilik asit türevi olarak da sayılabilirler, hidroksil grubu bir amin veya amonyakla yer değiştirmiştir.
Amid sözcüğünün ikinci bir anlamı, amonyak (NH3) veya bir aminin protonsuz hâli olan amid anyonudur. Genelde [R1NR2]- formülü ile gösterilir. Çok zayıf bir bazdır, çünkü amonyak ve türevleri, Brønsted asitleri olarak çok zayıftırlar.
Bir amin veya amonyaktaki azotun üzerindeki bir hidrojen atomunun bir metal katyonu ile değişmiş olduğu bileşikler de amid olarak bilinirler, bunlara azanid de denir.
Bu maddenin kalan kısmı amid sözcüğünün karbonil-azot anlamı hakkındadır. Anyonik amidlere örnek olarak Sodyum amid ve lityum diizopropilamid maddelerine bakınız.
Amid sentezi
[değiştir | kaynağı değiştir]- Amidler genel olarak karboksilik asidin bir aminle tepkimesi ile oluşurlar. Amino asitler arasında peptit bağlarını oluşturan bu tepkimedir. Bu amidler hidrojen bağı alıcısı ve vericisi olarak hidrojen bağları oluşturabilirler ama sulu çözeltilerde iyonlaşmazlar, oysa onları meydana getiren asit ve aminler nötral pH'de tamamen suda çözünürler. Amid oluşumu bazı yoğunlaşma polimerlerinin sentezinde rol oynar, örneğin naylon ve Aramid (Kevlar) gibi.
- Halkalı amidler Beckman düzenlenmesi ile oksimlerden sentezlenir.
- Amidler Willgerodt-Kindler reaksiyonunda aril alkil ketonlar, kükürt ve morfolinlerden hazırlanabilirler.
- Diğer amid oluşturan tepkimeler arasında Passerini tepkimesi ve Ugi tepkimesi bulunur.
Amid tepkimeleri
[değiştir | kaynağı değiştir]- Amidler amid hidrolizi yoluyla parçalanabilirler.
- Vilmeier-Haack tepkimesinde bir amid bir imine dönüşebilir.
- Hofmann düzenlenmesiyle birincil amidler birincil aminlere dönüşürler.
Amidler karbonil fonksiyonel gruplarının en kararlısıdır. Rezonans stabilizasyonu nedeniyle amidler fizyolojik şartlarda benzer esterlerden dâhi tepkisizdirler. Buna rağmen, amidler gene de tepkimeye girebilirler, genelde eğer karbonil atomuna bir elektronegatif atom saldırınca karbonil çift bağı kırılır ve tetrahedral bir ara bileşik oluşur. Amide saldıran fonksiyonel grup bir tiol, hidroksil veya amin olursa meydana gelen molekül bir siklol olarak veya daha özel olarak, sırasıyla, tiasiklol, oksasiklol veya azasiklol olarak adlandırılır.
Normal şartlarda amidin protonu ayrışmaz: pKa'sı genelde 15'in üzerindedir. Ancak, aşırı asit şartlarda karbonik oksijen yaklaşık pKa= -1 ile protonlaşabilir.
Amidlerin özellikleri
[değiştir | kaynağı değiştir]Amid bağı kinetik olarak hidroliz olmaz. Ancak hem kaynayan alkalide, hem de kuvvetli asit şartlarda hidrolize olabilir. Biyokimyada amid bağlarına peptit bağı denir. Amid bağları proteinin tanımlayıcı özelliklerinden biridir, proteinlerin ikincil yapıları kısmen amidlerin hidrojen bağı kurma özelliğine bağlıdır.
Aminlere kıyasla amidler zayıf bazlardir. Bir aminin eşlenik asidinin pKa'sı 9.5 dolayındayken, bir amidin eşlenik asidinin pKa'sı -0.5'tir. Dolayısıyla amidlerin suda pek belirgin asit-baz özellikleri yoktur. Bu bazlık noksanlığı karbonil grubunun elektron çekici özelliği ile açıklanır. Azottaki yalnız elektron çifti rezonans sonucu karbonil grubuna delokalize olur, karbonille bir çift bağ oluşturarak oksijende bir eksi yük oluşmasına neden olur. Öte yandan amidler karboksilik asitlere, esterlere, aldehitlere ve ketonlara kıyasla çok daha güçlü bazlardır, (eşlenik asit pKa'sı -6 ile -10 arasındadır).
Çözünürlük
[değiştir | kaynağı değiştir]Amidler, elektronegatif oksijen ve azot atomları ile elektro-nötr karbon atomları arasında kovalent bağlanmadan meydana gelen karbonil (C=O) ve eter (N-C) dipollerine sahiptir. Birincil ve ikincil amidler de, sırasıyla, iki ve bir N-H dipole sahiptirler. Karbonilin pi-bağlanma düzeninden ve oksijenin daha yüksek olan elektronegatifliği nedeniyle, karbonil (C=O) dipolu N-C dipolünden daha güçlüdür. C=O dipolünün varlığı ve N-C dipolünün de daha düşük oranda katkısı, amidlerin H-bağı alıcısı olmalarını sağlar. Dolayısıyla amidler su ve diğer protik çözücülerle hidrojen bağı kurabilir. Oksijen ve azot atomları sudan hidrojen bağları alırlar, N-H hidrojen atomarı da H-bağları verirler. Bu etkileşimler sayesinde amidlerin suda çözünürlükleri benzer hidrokarbonlardan daha yüksektir.
Hidrojen bağları hidrokarbonlara kıyasla amidleri suda daha çok çözünür yapsa da, tipik olarak amidlerin suda çözünürlüğü az sayılır. Benzer alkol ve karboksilik asitlere kıyasla daha az çözünürler çünkü 1) iyonlaşmazlar, 2) polar olmayan hidrokarbon kısımları vardır ve 3) üçüncül amidler suya hidrojen bağı veremezler (ancak hidrojen bağı alıcısı olabilirler). Bu yüzden amidlerin suda çözünürlükleri esterlerinkine benzer. Genelde amidler benzer amin ve karboksilik asitlerden daha az çözünürler, çünkü bu bileşikler hem hidrojen bağı verici hem de alıcısıdırlar ve uygun pH'lerde iyonlaşarak çözünürlüklerini daha da artırablirler.
Türevler
[değiştir | kaynağı değiştir]Sülfonamidlerde oksijene çift bağ yapan atom kabon değil kükürttür.
Halkalı amidlere laktam denir.
Adlandırma kuralları
[değiştir | kaynağı değiştir]- CH3CONH2 asetamid veya etanamid olarak adlandırılır.
- Başka örnekler: propan-1-amid, N,N-dimetilpropanamid, akrilamid
Dış bağlantılar
[değiştir | kaynağı değiştir]IUPAC kimya terminoloji özeti [1]24 Kasım 2016 tarihinde Wayback Machine sitesinde arşivlendi.: Amit sayfası [2] 21 Temmuz 2007 tarihinde Wayback Machine sitesinde arşivlendi.