Ammoniumjärn(II)sulfat
| Mohrs salt | |
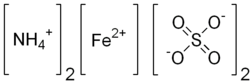 | |
| Systematiskt namn | Ammoniumjärn(II)sulfat |
|---|---|
| Kemisk formel | (NH4)2Fe(SO4)2 |
| Molmassa | 284,07 g/mol |
| Utseende | Blågröna kristaller |
| CAS-nummer | 10045-89-3 |
| SMILES | [Fe+2].[O-]S(=O)(=O)[O-].[O-]S(=O)(=O)[O-].[NH4+].[NH4+] |
| Egenskaper | |
| Densitet | 1,86 g/cm³ |
| Löslighet (vatten) | 269 |
| Smältpunkt | 100 - 110 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 3 250 mg/kg |
| SI-enheter & STP används om ej annat angivits | |
Ammoniumjärnsulfat eller Mohrs salt, är ett dubbelsalt av järnsulfat och ammoniumsulfat med formeln (NH4)2Fe(SO4)2(H2O)6. Det är ett vanligt laboratoriereagens eftersom det lätt kristalliseras och kristaller motstår oxidation med luft. Liksom de andra järnsulfatsalterna löses järnammoniumsulfat upp i vatten för att ge aquo-komplexet [Fe (H2O)6] 2+, som har oktaedrisk molekylär geometri.[1] Dess mineralform är mohrit.
Mohrs salt är uppkallat efter den tyska kemisten Karl Friedrich Mohr, som gjorde många viktiga framsteg med titreringsmetoden på 1800-talet.
Egenskaper
[redigera | redigera wikitext]Ammoniumjonerna kan frigöra protoner vilket gör lösningen aningen sur, vilket i sin tur motverkar Fe2+ att oxideras till Fe3+.

Förening ingår i en grupp dubbelsulfater som kallas Schönites eller Tuttons salter. Tuttons salter bildar monokliniska kristaller och har formel M2N(SO4)2.6H2O (M = olika monokationer). När det gäller bindningen består kristaller av oktaedra [Fe(H2O)6]2+-centra, som är vätebundna till sulfat och ammonium.[2]
Användning
[redigera | redigera wikitext]I analytisk kemi är detta salt den föredragna källan till järnjoner eftersom det fasta ämnet har en lång hållbarhet och är resistent mot oxidation. Denna stabilitet sträcker sig något till lösningar som återspeglar effekten av pH på järn/ järnhands redoxparet. Denna oxidation sker lättare vid högt pH. Ammoniumjonerna gör lösningar av Mohrs salt något sura, vilket saktar ner denna oxidationsprocess.[1][3] Svavelsyra tillsätts vanligtvis till lösningar för att minska oxidationen till järn.
Den används även i Frickes dosimeter för att mäta höga doser gammastrålning.[4]
Framställning
[redigera | redigera wikitext]Mohrs salt framställs genom att lösa upp en ekvimolär blandning av hydratiserat järnsulfat och ammoniumsulfat i vatten innehållande lite svavelsyra och sedan utsätta den resulterande lösningen för kristallisering. Järnammoniumsulfat bildar ljusgröna kristaller. Detta salt joniseras vid upphettning för att frige alla katjoner och anjoner som finns i det.
Föroreningar
[redigera | redigera wikitext]Vanliga föroreningar är magnesium, nickel, mangan, bly och zink, varav vissa bildar isomorfa salter.[5]
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Ammonium iron(II) sulfate, 7 mars 2022.
Noter
[redigera | redigera wikitext]- ^ [a b] Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Ephraim, Fritz (1926). Inorganic Chemistry. tr P. C. L. Thorne. London: Gurney and Jackson. sid. 484–485
- ^ ”Ammonium Ferrous Sulphate 100 g (Mohr's Salt)”. 2012. Arkiverad från originalet den 31 augusti 2017. https://web.archive.org/web/20170831170556/http://oxfordchemserve.com/ammonium-ferrous-sulphate-100-g-mohrs-salt. Läst 13 juni 2013.
- ^ Hickman, C.; Lorrain, S.; Barthe, J.R.; Portal, G. (1986). ”Use of Mohr's Salt for High Level Gamma Dosimetry (Up to 108 Gy)”. Radiation Protection Dosimetry (Oxford Journals) 17 (1–4): sid. 255–257. doi:.
- ^ Vogel, Arthur I. (1961). A Text-book of Quantitative Inorganic Analysis Including Elementary Instrumental Analysis (3). Longmans. sid. 281–282
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Ammoniumjärn(II)sulfat.
Wikimedia Commons har media som rör Ammoniumjärn(II)sulfat.


