Sumpor trioksid
| |||
| Nazivi | |||
|---|---|---|---|
| Preferisani IUPAC naziv
Sulfur trioxide | |||
| Sistemski IUPAC naziv
Sulfonilidenoksidan | |||
| Drugi nazivi
anhidrid sumporne kiseline
| |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.361 | ||
| EC broj | 231-197-3 | ||
| Gmelin Referenca | 1448 | ||
| RTECS | WT4830000 | ||
| UN broj | UN 1829 | ||
| |||
| Svojstva | |||
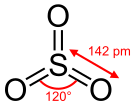
| SO3 | |||
| Molarna masa | 80,066 g/mol | ||
| Gustina | 1,92 g/cm3, tečnost | ||
| Tačka topljenja | 16.9 °C, 290.1 K, 62.4°F | ||
| Tačka ključanja | 45 °C (113 °F; 318 K) | ||
| hidrolizuje se do sumporne kiseline | |||
| Termohemija | |||
| Standardna molarna entropija S |
256.77 J K−1 mol−1}} | ||
Std entalpija
formiranja (ΔfH⦵298) |
−397.77 kJ/mol | ||
| Opasnosti | |||
EU klasifikacija (DSD)
|
oksidans (ox) | ||
| R-oznake | R14, R35, R37 | ||
| S-oznake | (S1/2), S26, S30, S45 | ||
| NFPA 704 | |||
| Tačka paljenja | Nezapaliv | ||
| Letalna doza ili koncentracija (LD, LC): | |||
LC50 (LC50)
|
pacov, 4 h 375 mg/m3 | ||
| Srodna jedinjenja | |||
Drugi katjoni
|
Selen trioksid Telur trioksid | ||
| Sumpor monoksid Sumpor dioksid | |||
Srodna jedinjenja
|
Sumporna kiselina | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Sumpor trioksid (sumpor (VI) oksid) je hemijsko jedinjenje sa formulom SO3.[3][4] On je gas koji je zagađivač vazduhu i sastojak kiselih kiša.
Dobijanje
[уреди | уреди извор]Sumpor trioksid se ne može dobiti izgaranjem sumpora u vazduhu ili u atmosferi kiseonika, jer velika količina toplote koja se oslobađa pri sagorevanju sumpora u sumpor dioksid sprečava stvaranje sumpor trioksida. SO3 se egzotermno raspada na višim temperaturama u sumpor dioksid i kiseonik.
Spajanje sumpor-dioksida i kiseonika je moguće samo na temperaturama koje nisu suviše visoke (400—600 °C). Zbog vrlo male brzine reakcije u tom temperaturnom području neohodna je upotreba katalizatora. Ovaj postupak nalazi industrijsku primenu u proizvodnji sumporne kiseline.
Za laboratorijske potrebe, sumpor trioksid se priprema kao anhidrid sumporne kiseline, oduzimanjem vode sumpornoj kiselini (zagrevanjem koncentrovane sumporne kiseline s fosfor pentoksidom kao sredstvom za oduzimanje vode):
- H2SO4 → SO3 + H2O
ili zagrevanjem vodoniksulfata (npr. natrijum-bisulfata NaHSO4), ili sulfata npr. gvožđe(III)-sulfata (Fe2(SO4)3).
Osobine
[уреди | уреди извор]
Sumpor trioksid pojavljuje se u tri modifikacije, od kojih je jedna kristalna, a preostale dve su amorfni oblici. Kada se ohlade pare sumpor trioksida, dolazi do kondenzacije u kristalni oblik (γ-SO3). To je prozirna masu, koja se topi na 16,8 °C, a ključa na 44,8 °C. Ona se u čvrstom stanju sastoji uglavnom od molekula (SO3)3, u tečnom stanju od molekula (SO3)3 i SO3, a u gasovitom stanju od molekula SO3. Ako se sumpor trioksid drži duže vremena ispod 25 °C, on se pretvara u modifikaciju sličnu azbestu (β i α SO3), odnosno u bele isprepletene iglice svilenastog sjaja, s molekulima (SO3)n i (SO3)p (p > n > 3). Sumpor trioksid koji je u prodaji je mešavina α i β SO3.
Sumpor trioksid se spaja sa vodom i gradi sumpornu kiselinu uz jako razvijanje toplote. Na vlažnom vazduhu intenzivno se puši, jer je prilično isparljiv, pa s vlagom iz vazduha stvara sumpornu kiselinu, koja se odmah kondenzuje u male kapljice. Sa oksidima metala reaguje energično uz stvaranje sulfata.
Reference
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.