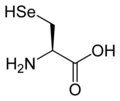
Proteinogena aminokiselina

Proteinogene aminokiseline su aminokiseline koje ulaze u sastav proteina i koje su neophodne za formiranje proteina ćelijskim mehanizmom dekodiranja genetičkog koda[1][2]. Postoje 22 standardne aminokiseline. Kod eukariota je nađena 21 kiselina iz te grupe. Od 22 standardne kiseline, 20 su direktno kodirane univerzalnim genetičkim kodom. Ljudi mogu da sintetišu 11 od tih 20, jednu iz druge ili iz drugih molekula intermedijarnog metabolizma. Drugih 9 se mora uneti hranom, te se stoga nazivaju esencijalnim aminokiselinama. One su histidin, izoleucin, leucin, lizin, metionin, fenilalanin, treonin, triptofan, i valin. Ostale dve, selenocistein i pirolizin, se inkorporiraju u proteine putem jedinstvenih sintetičkih mehanizama.
Reč "proteinogene" znači "protein gradeće". Proteinogene aminokiseline mogu se kondenzovati u polipeptid (podjedinicu proteina) u procesu koji se zove translacija (druga faza biosinteze proteina, deo ukupnog procesa ekspresije gena).[3][4][5][6]
Nasuprot tome, neproteinogene aminokiseline ili nisu uključene u proteine (poput GABA, L-DOPA, ili trijodtironina) ili se ne proizvode direktno u izolaciji i standardnim ćelijskim procesima (poput hidroksiprolina i selenometionina). Ove kasnije često nastaju putem posttranslacione modofikacije proteina. Za proteinogene aminokiseline je poznato da ih prepoznaje ribozimski autoaminoacilacijski sistem.[7] Stoga su neproteinogene aminokiseline isključene iz kontingenta evolucijski uspešnih nukleotidno-baziranih oblika života. Drugi razlozi su ponuđeni za objanjavanje razloga zašto neke specifične neproteinogene aminokiseline nisu generalno uključene u proteine: na primer, ornitin i homoserin se ciklizuju sa osnovom peptida i fragmentiraju protein s relativno kratkim poluživotom, dok su druge toksične jer se mogu pogrešno ugraditi u proteine, kao što je argininski analog kanavanin.
Neproteinogene aminokiseline su sadržane u neribozomnim peptidima, koji se ne proizvode u ribozomima tokom translacije.
Strukture
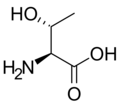
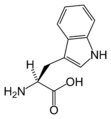
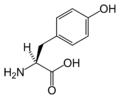
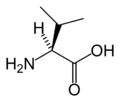
[уреди | уреди извор]Slede ilustruje struktura i skraćenice 21 aminokiseline koje su direktno kodirane za sintezu proteina u genetičkom kodu eukariota. Strukture koje su date u nastavku su standardne hemijske strukture, a ne tipični bipolni oblici koji postoje u vodenim rastvorima.

-
L-Alanin
(Ala / A) -
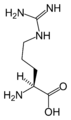
L-Arginin
(Arg / R) -
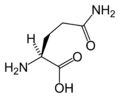
L-Asparagine
(Asn / N) -
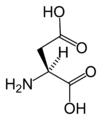
L-Aspartic acid
(Asp / D) -
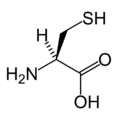
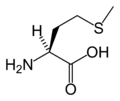
L-Cistein
(Cys / C) -
L-Glutaminska kiselina
(Glu / E) -
L-Glutamin
(Gln / Q) -
Glicin
(Gly / G) -
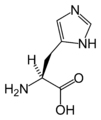
L-Histidin
(His / H) -
L-Izoleucin
(Ile / I) -
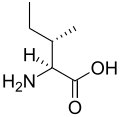
L-Leucin
(Leu / L) -
L-Lizin
(Lys / K) -
L-Metionin
(Met / M) -
L-fenilalanin
(Phe / F) -
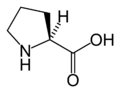
L-Prolin
(Pro / P) -
L-Serin
(Ser / S) -
L-Treonin
(Thr / T) -
L-Triptofan
(Trp / W) -
L-Tirozin
(Tyr / Y) -
L-Valin
(Val / V)
IUPAC/IUBMB takođe preporučuju standardne oznake za sledeće aminokiseline:
-
L-Selenocistein
(Sec / U) -
L-Pirolizin
(Pyl / O)
Nespecifične skraćenice
[уреди | уреди извор]Ponekad se specifičnost identiteta aminokiseline ne može odrediti jednoznačno. Određene tehnike proteinskog sekvenciranja ne prave razliku među pojedinim parovima. Zato se koriste ovi kodovi:
- Asx (B) je "asparagin ili asparaginska kiselina"
- Glx (Z) je "glutaminska kiselina ili glutamin"
- Xle (J) je "leucin ili izoleucin"
Dodatno, simbol X je upotrebljen za oznaku aminokiseline koja je kompletno neidentificirana.
Hemijska svojstva
[уреди | уреди извор]U nastavku je tabela sa jednoslovnim i troslovnim simbolima i hemijskim svojstvima bočnih lanaca standardnih aminokiselina. Navedene mase su bazirane na ponderiranom proseku elementarnih izotopa njihove prirodne zastuplenosti. Formiranje peptidne veze dovodi do eliminacije molekula vode, tako da je jedinice mase aminokiselina u proteinskim lancima smanjena za 18,01524 Da.
Opšta hemijska svojstva
| Aminokiselina | Kratko | Skraćenica | Atomska masa (Da) | Izoelektrična tačka (pI) | Disocijacijska konstanta pK1 (α-COOH) |
pK2 (α-+NH3) |
|---|---|---|---|---|---|---|
| Alanin | A | Ala | 89.09404 | 6.01 | 2.35 | 9.87 |
| Cistein | C | Cys | 121.15404 | 5.05 | 1.92 | 10.70 |
| Asparaginska kiselina | D | Asp | 133.10384 | 2.85 | 1.99 | 9.90 |
| Glutaminska kiselina | E | Glu | 147.13074 | 3.15 | 2.10 | 9.47 |
| Fenilalanin | F | Phe | 165.19184 | 5.49 | 2.20 | 9.31 |
| Glicin | G | Gly | 75.06714 | 6.06 | 2.35 | 9.78 |
| Histidin | H | His | 155.15634 | 7.60 | 1.80 | 9.33 |
| Izoleucin | I | Ile | 131.17464 | 6.05 | 2.32 | 9.76 |
| Lizin | K | Lys | 146.18934 | 9.60 | 2.16 | 9.06 |
| Leucin | L | Leu | 131.17464 | 6.01 | 2.33 | 9.74 |
| Metionin | M | Met | 149.20784 | 5.74 | 2.13 | 9.28 |
| Asparagin | N | Asn | 132.11904 | 5.41 | 2.14 | 8.72 |
| Pirolizin | O | Pyl | 255.31 | |||
| Prolin | P | Pro | 115.13194 | 6.30 | 1.95 | 10.64 |
| Glutamin | Q | Gln | 146.14594 | 5.65 | 2.17 | 9.13 |
| Arginin | R | Arg | 174.20274 | 10.76 | 1.82 | 8.99 |
| Serin | S | Ser | 105.09344 | 5.68 | 2.19 | 9.21 |
| Treonin | T | Thr | 119.12034 | 5.60 | 2.09 | 9.10 |
| Selenocistein | U | Sec | 168.053 | 5.47 | ||
| Valin | V | Val | 117.14784 | 6.00 | 2.39 | 9.74 |
| Triptofan | W | Trp | 204.22844 | 5.89 | 2.46 | 9.41 |
| Tirozin | Y | Tyr | 181.19124 | 5.64 | 2.20 | 9.21 |
Osobenosti bočnog lanca
[уреди | уреди извор]| Aminokiselina | Kratko | Skraćenica | Bočni lanac | Hidro- fobna |
Disocijacijska konstanta (pK) | Polarnost | pH | Mala | Sitna | Aromatična ili alifatična | Van der Valsova zapremina |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Alanin | A | Ala | -CH3 | X | - | - | - | X | X | - | 67 |
| Cistein | C | Cys | -CH2Tiol (SH) | X | 8.18 | - | Kisela | X | X | - | 86 |
| Asparaginska kiselina | D | Asp | -CH2COOH | - | 3.90 | X | Kisela | X | - | - | 91 |
| Glutaminska kiselina | E | Glu | -CH2CH2COOH | - | 4.07 | X | Kisela | - | - | - | 109 |
| Fenilalanin | F | Phe | -CH2C6H5 | X | - | - | - | - | - | Aromatska | 135 |
| Glicin | G | Gly | -H | X | - | - | - | X | X | - | 48 |
| Histidin | H | His | -CH2-C3H3N2 | - | 6.04 | X | Blago bazna | - | - | Aromatska | 118 |
| Izoleucin | I | Ile | -CH(CH3)CH2CH3 | X | - | - | - | - | - | Alifatska | 124 |
| Lizin | K | Lys | -(CH2)4NH2 | - | 10.54 | X | Bazna | - | - | - | 135 |
| Leucin | L | Leu | -CH2CH(CH3)2 | X | - | - | - | - | - | Alifatska | 124 |
| Metionin | M | Met | -CH2CH2SCH3 | X | - | - | - | - | - | - | 124 |
| Asparagin | N | Asn | -CH2CONH2 | - | - | X | - | X | - | - | 96 |
| Pirolizin | O | Pyl | -(CH2)4NHCOC4H5NCH3 | - | - | X | Blago bazna | - | - | - | |
| Prolin | P | Pro | -CH2CH2CH2- | X | - | - | - | X | - | - | 90 |
| Glutamin | Q | Gln | -CH2CH2CONH2 | - | - | X | Blago bazna | - | - | - | 114 |
| Arginin | R | Arg | -(CH2)3NH-C(NH)NH2 | - | 12.48 | X | Jako bazna | - | - | - | 148 |
| Serin | S | Ser | -CH2OH | - | 5.68 | X | Blago kisela | X | X | - | 73 |
| Treonin | T | Thr | -CH(OH)CH3 | - | 5.53 | X | Blago kisela | X | - | - | 93 |
| Selenocistein | U | Sec | -CH2SeH | - | 5.73 | - | Kisela | X | X | - | |
| Valin | V | Val | -CH(CH3)2 | X | - | - | - | X | - | Aliphatska | 105 |
| Triptofan | W | Trp | -CH2C8H6N | - | 5.885 | X | Blago bazna | - | - | Aromatična | 163 |
| Tirozin | Y | Tyr | -CH2-C6H4OH | - | 10.46 | X | Blago kisela | - | - | Aromatska | 141 |
Napomena: pKa vrijednosti aminokiselina su obično malo drugačije kada su unutar proteina. U ovoj situaciji, proteinski pKa proračuni se ponekad koriste za izračunavanje promjena u pKa vrijednosti aminokiselina.
Genska ekspresija i biohemija
[уреди | уреди извор]| Aminokiselina | Kratko | Skraćenica | Kodon(i) | Pojava u ljudskim proteinima (%) |
Esencijalne‡ kod ljudi |
|---|---|---|---|---|---|
| Alanin | A | Ala | GCU, GCC, GCA, GCG | 7.8 | No |
| Cistein | C | Cys | UGU, UGC | 1.9 | Uvjetno |
| Asparaginska kiselina | D | Asp | GAU, GAC | 5.3 | Ne |
| Glutaminska kiselina | E | Glu | GAA, GAG | 6.3 | Uvjetno |
| Fenilalanin | F | Phe | UUU, UUC | 3.9 | Da |
| Glicin | G | Gly | GGU, GGC, GGA, GGG | 7.2 | Uvjetno |
| Histidin | H | His | CAU, CAC | 2.3 | Da |
| Izoleucin | I | Ile | AUU, AUC, AUA | 5.3 | Da |
| Lizin | K | Lys | AAA, AAG | 5.9 | Da |
| Leucin | L | Leu | UUA, UUG, CUU, CUC, CUA, CUG | 9.1 | Da |
| Metionin | M | Met | AUG | 2.3 | Da |
| Asparagin | N | Asn | AAU, AAC | 4.3 | Ne |
| Pirolizin | O | Pyl | UAG* | 0 | Ne |
| Prolin | P | Pro | CCU, CCC, CCA, CCG | 5.2 | Ne |
| Glutamin | Q | Gln | CAA, CAG | 4.2 | Ne |
| Arginin | R | Arg | CGU, CGC, CGA, CGG, AGA, AGG | 5.1 | Uvjetno |
| Serin | S | Ser | UCU, UCC, UCA, UCG, AGU, AGC | 6.8 | Ne |
| Treonin | T | Thr | ACU, ACC, ACA, ACG | 5.9 | Da |
| Selenocistein | U | Sec | UGA** | >0 | Ne |
| Valin | V | Val | GUU, GUC, GUA, GUG | 6.6 | Da |
| Triptofan | W | Trp | UGG | 1.4 | Yes |
| Tirozin | Y | Tyr | UAU, UAC | 3.2 | Uvjetno |
| Stop kodon† | - | Term | UAA, UAG, UGA†† | - | - |
* UAG je normalno amber stop kodon, ali i kodiranje pirrolizina ako je prisutan PYLIS element.
** UGA je normalno opal (ili amber) stop kodon, ali kodira i selenocistein, je prisutan SECIS element.
†Stop kodon nije aminokiselina, ali je uključen za kompletiranje šifre.
†† UAG i UGA ne deluju uvek kao stop kodoni (vidi gore).
‡ Esencijalna aminokiselina se ne može sintetisati kod ljudi, pa se mora konzumirati. Uslovne esencijalne aminokiseline obično nisu neophodne u ishrani, ali moraju biti egzogeno dodavane specifičnim grupama ljudi koji ih ne sintetišu u dovoljnoj količini.
Masena spektofotometrija
[уреди | уреди извор]U masenoj spektrofotometriji peptida i proteina, korisno je poznavanje mase ostataka. Masa peptida ili proteina je zbir mase ostatka plus masa vode.[8]
| Aminokiselina | Kratko | Skraćenica | Formula | Atomska masa (Da) | Atomska masa (Da) |
|---|---|---|---|---|---|
| Alanin | A | Ala | C3H5NO | 71.03711 | 71.0788 |
| Cistein | C | Cys | C3H5NOS | 103.00919 | 103.1388 |
| Asparaginska kiselina | D | Asp | C4H5NO3 | 115.02694 | 115.0886 |
| Glutaminska kiselina | E | Glu | C5H7NO3 | 129.04259 | 129.1155 |
| Fenilalanin | F | Phe | C9H9NO | 147.06841 | 147.1766 |
| Glicin | G | Gly | C2H3NO | 57.02146 | 57.0519 |
| Histidin | H | His | C6H7N3O | 137.05891 | 137.1411 |
| Izoleucin | I | Ile | C6H11NO | 113.08406 | 113.1594 |
| Lizin | K | Lys | C6H12N2O | 128.09496 | 128.1741 |
| Leucin | L | Leu | C6H11NO | 113.08406 | 113.1594 |
| Metionin | M | Met | C5H9NOS | 131.04049 | 131.1986 |
| Asparagin | N | Asn | C4H6N2O2 | 114.04293 | 114.1039 |
| Pirolizin | O | Pyl | C12H21N3O3 | 255.15829 | 255.3172 |
| Prolin | P | Pro | C5H7NO | 97.05276 | 97.1167 |
| Glutamin | Q | Gln | C5H8N2O2 | 128.05858 | 128.1307 |
| Arginin | R | Arg | C6H12N4O | 156.10111 | 156.1875 |
| Serin | S | Ser | C3H5NO2 | 87.03203 | 87.0782 |
| Treonin | T | Thr | C4H7NO2 | 101.04768 | 101.1051 |
| Selenocistein | U | Sec | C3H5NOSe | 150.95364 | 150.0388 |
| Valin | V | Val | C5H9NO | 99.06841 | 99.1326 |
| Triptofan | W | Trp | C11H10N2O | 186.07931 | 186.2132 |
| Tirozin | Y | Tyr | C9H9NO2 | 163.06333 | 163.1760 |
Stehiometrija i metabolička potrošnja u ćeliji
[уреди | уреди извор]Naredna tabela navodi obilje aminokiselina u ćeliji Escherichia coli i metabolički utrošak ATP za sintezu aminokiselina. Negativni brojevi ukazuju na metaboličke procese koji su energetski povoljni i ne troše neto ATP ćelije. Skup raspoloživih aminokiselina sadrži one u obliku i u polimeriziranom obliku (proteini).
| Aminokiselina | Abundancija (molekula×108) po ćeliji E. coli) |
Utrošak ATP u sintezi u aerobnim uvjetima |
Utrošak ATP u sintezi u anaerobnim uvjetima |
|---|---|---|---|
| Alanin | 2.9 | -1 | 1 |
| Cistein | 0.52 | 11 | 15 |
| Asparaginska kiselina | 1.4 | 0 | 2 |
| Glutaminska kiselina | 1.5 | -7 | -1 |
| Fenilalanin | 1.1 | -6 | 2 |
| Glicin | 3.5 | -2 | 2 |
| Histidin | 0.54 | 1 | 7 |
| Izoleucin | 1.7 | 7 | 11 |
| Lizin | 2.0 | 5 | 9 |
| Leucin | 2.6 | -9 | 1 |
| Metionin | 0.88 | 21 | 23 |
| Asparagin | 1.4 | 3 | 5 |
| Prolin | 1.3 | -2 | 4 |
| Glutamin | 1.5 | -6 | 0 |
| Arginin | 1.7 | 5 | 13 |
| Serin | 1.2 | -2 | 2 |
| Treonin | 1.5 | 6 | 8 |
| Triptofan | 0.33 | -7 | 7 |
| Tirozin | 0.79 | -8 | 2 |
| Valin | 2.4 | -2 | 2 |
Napomene
[уреди | уреди извор]| Aminokiselina | Skraćenica | Napomena | |
|---|---|---|---|
| Alanin | A | Ala | Vrlo bogat i vrlo svestran, krući od glicina, ali dovoljno mali da predstavlja samo mala prostorna ograničenja za proteinske konformacije. Ponaša se prilično neutralno, a može se nalaziti u obe hidrofilne regije na proteinu, izvan i unutar hidrofobnih područja. |
| Asparagin ili asparaginska kiselina | B | Asx | Drži mesto kada bilo koja aminokiselina može zauzeti tu poziciju |
| Cistein | C | Cys | Atom sumpora se lako veže za jone teških metala. Pod oksidirajućim uslovima, dva cisteina se mogu udružiti u disulfid i formirati aminokiselinu cistin. Kada su cistini deo proteina, insulina na primjer, tercijarna struktura je stabilizovana, što čini protein otpornijim na denaturacije. Zato su disulfidne veze česte u proteinima koji moraju biti u funkciji u teškim uslovima, uključujući probavne enzime (npr. pepsin i himotripsin) i strukturne proteine (npr. keratin). Disulfidne veze se takođe nalaze u peptidima koji su premali da sami održe stabilan oblik (npr. insulin). |
| Asparaginska kiselina | D | Asp | Asp se ponaša slično glutaminskoj kiselini, a nosi hidrofilnu kiselu grupu sa jakim negativnim nabojem. Obično se nalazi na spoljnoj površini proteina, koji je rastvorljiv u vodi. Veže se za molekule i jone pozitivnog naboja, a često se koristi u enzimima za fiksiranje metalnih jona. Kada se nalaze unutar proteina, aspartat i glutamat su obično upareni sa argininom i lizinom. |
| Glutaminska kiselina | E | Glu | Glu se ponaša slično asparaginskoj kiselini, a ima duže, nešto fleksibilnije bočne lance. |
| Fenilalanin | F | Phe | Esencijalni za ljude, fenilalanin, tirozin i triptofan sadrže velike, krute aromatične grupe u bočnom lancu. To su najveće aminokiseline. Hidrofobne su kao i izoleucin, leucin, valin i imaju tendenciju da se orijentišu prema unutrašnjosti proteinskih molekula. Fenilalanin se može pretvoriti u tirozin. |
| Glicin | G | Gly | Zbog dva atoma vodonika na α ugljiku, glicin nije optički aktivan. To je najmanja aminokiselina, rotira lako i daje fleksibilnost proteinskom lancu. Može da se uklopi u uskim mestima, npr. trostruki heliks kolagena. Pošto previše fleksibilnosti obično nije poželjno kao strukturna komponenta, manje je uobičajen od alanina. |
| Histidin | H | His | Od suštinskog je značaja za ljude. Čak i u blago kiselim uslovima, dolazi se protonacija azota, što menja svojstva histidina i polipeptida u celini. Nalazi se u mnogim proteinima kao regulatorni mehanizam, promenom konformacije i ponašanje polipeptida u kiselim područjima, kao što su kasni endozomi ili lizozomi, provođenje promena konformacija u enzimima. Međutim, za to je potrebno samo nekoliko histidina, tako da je relativno oskudan. |
| Izoleucin | I | Ile | Od esencijalnog značaja je za ljude. Izoleucin, leucin i valin i imaju velike alifatične hidrofobne bočne lance. Njihovi molekuli su kruti, a međusobne hidrofobne interakcije su važne za pravilno sklapanje proteina, jer ovi lanci imaju tendenciju da se nalaze unutar molekula proteina. |
| Leucin ili izoleucin | J | Xle | Čuva mesto kada bilo koja aminokiselina može zauzeti tu poziciju |
| Lizin | K | Lys | Lizin je od suštinskog značaja za ljude, a ponaša se slično argininu. Sadrži dug, fleksibilan bočni lanac s pozitivnim nabojem na kraju. Fleksibilnost lanca čini lizin i arginin pogodnim za vezivanje molekula s mnogim negativnim nabojima na svojoj površini. Npr. DNK - vezujući proteini imaju aktivnu regiju bogatu argininom i lizinom. Snažan naboj čini ove dve aminokiseline sklonim za spoljne hidrofilne površine proteina. Kada se nalaze unutra, obično su upareni s odgovarajućim negativno naelektrisanim aminokiselinama, npr. aspartatom ili glutamatom. |
| Leucin | L | Leu | Leu je esencijalan za ljude, a ponaša se slično izoleucinu i valinu. |
| Metionin | M | Met | Met je od esencijalnog og značaja za ljude. Uvek je prva aminokiselina koja biva uključena u protein, a ponekad je uklonjen nakon translacije. Kao i cistein, sadrži sumpor, ali sa metil grupom, umesto vodonika. Ova metil grupa se može aktivirati, a koristi se u mnogim reakcijama u kojima se dodaju novi atomi ugljenika na drugi molekul. |
| Asparagin | N | Asn | Slično asparaginskoj kiselini, Asn sadrži amidnu grupu, gdje Asp ima karboksil. |
| Pirolizin | O | Pyl | Sličan lizinu, ali ima priključen prolinski prsten. |
| Prolin | P | Pro | Prolin sadrži neobičan prsten sa amino grupom N-kraja, koji prisiljava CO-NH amidnu sekvencu na fiksnu konformaciju. To može poremetiti sklopove proteinske strukture, poput α heliksa ili β lista. Uobičajen je u kolagenu, često prolazi kroz posttranslacione modifikacije u hidroksiprolinu. |
| Glutamin | Q | Gln | Slično glutaminskoj kiselini, Gln sadrži amidnu grupu, u kojoj Glu ima karboksilnu. Nalazi se u proteinima i kao spremište za amonijak; najobilnija je aminokiselina u organizmu. |
| Arginin | R | Arg | Funkcionalno sličan lizinu |
| Serin | S | Ser | Serin i treonin imaju kratke molekule koje završavaju hidroksilnom grupom. Njegov vodonik je lako ukloniti, tako da serin i treonin često ponašaju kao donatorai vodonika u enzimima. Oba su vrlo hidrofilna, tako da su spoljne regije rastvorljivih proteina bogate ovim aminokiselinama. |
| Treonin | T | Thr | Esencijalan za ljude, Thr se ponaša slično serinu. |
| Selenocistein | U | Sec | Seleniran iz cisteina, gde selen zamjenjuje sumpor. |
| Valin | V | Val | Esencijalan za ljude, Val se ponaša slično izoleucinu i leucinu. |
| Triptofan | W | Trp | Esencijalan za ljude, Trp se ponaša slično fenilalaninu i tirozinu. Prekursor je serotonina i prirodno je fluorescentan. |
| Nepoznati | X | Xaa | „Čuvar mesta“ kada je nepoznata aminokiselina beznačajna. |
| Tirozin | Y | Tyr | Tyr se ponaša slično fenilalaninu (prethodnik tirozina) i triptofanu, a preteča je melanina, epinefrina i hormona štitnjače. Njegova fluorescencija se obično javlja kao posljedica energetskog transfera u triptofan. |
| Glutaminska kiselina ili glutamin | Z | Glx | Čuvar mesta kada bilo koja aminokiselina može zauzeti datu poziciju. |
Katabolizam
[уреди | уреди извор]
- Glukogene, sa produktima koji imaju sposobnost formiranja glukoze putem glukogeneze.
- Ketogene, sa produktima koji nemaju sposobnost formiranja glukoze: ovi produkti se mogu upotrebiti za ketogenezu ili sintezu lipida.
- Aminokiseline katabolizirane i glukogenim i and ketogenim produktima.
Život na bazi alternativnih proteinogenih garnitura
[уреди | уреди извор]Prema dosadašnjim saznanjima, čini se da su proteinogene garniture koje koriste poznati oblici života na Zemlji, proizvoljno odabrane evolucijom, od više stotina mogućih alfa-tipova aminokiselina. Ksenobiologija studira hipotetske oblike života koji bi mogli biti izgrađeni korištenjem alternativnih skupova proširivanjem genetičkoih kodova. Milerov tip eksperimenta na veptačkom samozačeću pokazuje da alfa-tipovi aminokiselina dominiraju u osnovnoj vodi 'primordijalne supe', ali beta-tip aminokiselina dominira kada je prisutno manje vode. Oba, i alfa- i beta-bazirani setovi mogli su biti osnova za alternativne konstrukcije proteina i oblike života.
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ Ambrogelly A, Palioura S, Söll D (2007). „Natural expansion of the genetic code”. Nat Chem Biol. 3 (1): 29—35. PMID 17173027. doi:10.1038/nchembio847.
- ^ Donald Voet; Judith G. Voet (2005). Biochemistry (3 изд.). Wiley. ISBN 9780471193500.
- ^ Kornberg A. (1989): For the love of enzymes – The Odyssay of a biochemist. Harvard University Press, Cambridge (Mass.), London,ISBN 0-674-30775-5, ISBN 0-674-30776-3.
- ^ Graeme K. Hunter G. K. (2000): Vital Forces. The discovery of the molecular basis of life. Academic Press, London 2000, ISBN 0-12-361811-8.
- ^ Nelson D. L., Michael M. Cox M. M. (2013): Lehninger Biochemie. Springer, ISBN 978-3-540-68637-8.
- ^ Nelson D. L., Michael M. Cox M. M. (2013): Lehninger Principles of Biochemistry. W. H. Freeman, 2013.ISBN 978-1-4641-0962-1.
- ^ Erives A (2011). „A Model of Proto-Anti-Codon RNA Enzymes Requiring L-Amino Acid Homochirality”. J Molecular Evolution. 73: 10—22. PMC 3223571
 . PMID 21779963. doi:10.1007/s00239-011-9453-4.
. PMID 21779963. doi:10.1007/s00239-011-9453-4.
- ^ http://education.expasy.org/student_projects/isotopident/htdocs/aa-list.html |title=The amino acid masses |accessdate=2009-01-06, publisher: ExPASy.
Literatura
[уреди | уреди извор]- Nelson, David L.; Cox, Michael M. (2000). Lehninger Principles of Biochemistry (3rd изд.). Worth Publishers. ISBN 978-1-57259-153-0.
- Kyte, J.; Doolittle, R. F. (1982). „A simple method for displaying the hydropathic character of a protein”. J. Mol. Biol. 157 (1): 105—132. PMID 7108955. doi:10.1016/0022-2836(82)90515-0.
- Meierhenrich, Uwe J. (2008). Amino acids and the asymmetry of life (1st изд.). Springer. ISBN 978-3-540-76885-2.