Flytende ozon er mørkeblå, fast ozon er mørkfiolett. Ozon har kokepunkt −111,85 °C, smeltepunkt −192,65 °C, tetthet 2,144 g/L (litervekt). Ozon er et meget kraftig oksidasjonsmiddel, nest etter fluor det sterkeste som er kjent.
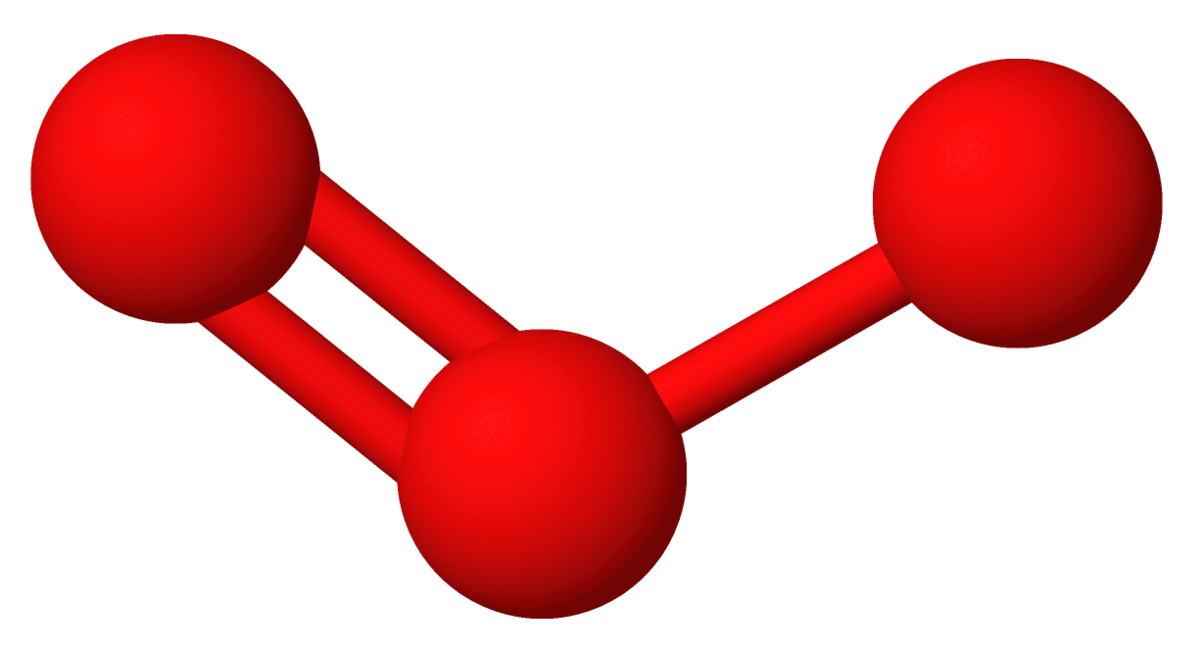
Med alkali- og jordalkalimetallene dannes ozonider, som er salter som inneholder ionet O3−, for eksempel kaliumozonid KO3. Ionet er vinklet og bindingslengden er 135 pm, noe lenger enn i ozon, der bindingslengden er 128 pm. Med umettede organiske forbindelser dannes ozonider ved at ozon adderes til dobbeltbindingene. Disse organiske ozonidene er molekylforbindelser.
Ozon oksiderer nesten alle metaller til deres høyeste oksidasjonstrinn. Sulfider oksideres for eksempel til sulfater, og kull ved vanlig temperatur til karbondioksid. Mange organiske fargestoffer blekes av ozon. Alkohol og fett kan under visse omstendigheter antennes.
I konsentrert tilstand er ozon eksplosivt. I fortynnet tilstand spaltes ozon langsomt ved alminnelig temperatur i det mer stabile dioksygen, det vanlige oksygenmolekylet: 2O3 ⇆ 3O2. Spaltningen påskyndes av katalytisk virkende stoffer, for eksempel brunstein. Også ultrafiolett stråling påskynder spaltningen. Ved oppvarming til 100 °C spaltes selv fortynnet ozon nesten momentant.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.