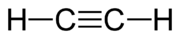Acetylén
| Etín | |||||||||||||
 | |||||||||||||
| Všeobecné vlastnosti | |||||||||||||
| Sumárny vzorec | C2H2 | ||||||||||||
| Synonymá | acetylén | ||||||||||||
| Vzhľad | bezfarebný plyn | ||||||||||||
| Fyzikálne vlastnosti | |||||||||||||
| Molekulová hmotnosť | 26,0373 g/mol | ||||||||||||
| Teplota topenia | -84 °C | ||||||||||||
| Teplota varu | -83,8 °C | ||||||||||||
| Kritický bod | 35,2 °C 6190 kPa | ||||||||||||
| Hustota | 1,09670 kg/m³ (plyn) | ||||||||||||
| Termochemické vlastnosti | |||||||||||||
| Štandardná zlučovacia entalpia | +226.88 kJ/mol | ||||||||||||
| |||||||||||||
| Ďalšie informácie | |||||||||||||
| Číslo CAS | 74-86-2 | ||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||
Acetylén (systematické pomenovanie etín) je chemická zlúčenina patriaca medzi uhľovodíky, konkrétne do skupiny alkínov.[1] Objavil ho v roku 1836 Ír Edmund Davy. Za normálnych podmienok je to plynná bezfarebná látka bez zápachu (technický acetylén má nepríjemný cesnakový zápach), ktorá so vzduchom vytvára vysoko výbušnú zmes.[1]
Výroba
[upraviť | upraviť zdroj]Hydratáciou karbidu vápenatého
[upraviť | upraviť zdroj]- Vstup: oxid vápenatý, uhlie (resp. koks)
- Výstup: karbid vápenatý, oxid uhoľnatý
- CaO + 3 C → CaC2 + CO
- Vstup: karbid vápenatý, voda;
- Výstup: acetylén, hydroxid vápenatý
- CaC2 + 2 H2O → Ca(OH)2 + C2H2 [1]
Produkcia plynu je 347 litrov na 1 kg karbidu vápenatého. Výhoda je v skladovateľnosti karbidu vápenatého a rýchlej produkcii acetylénu pri jeho hydratovaní.
Krakovaním ľahkých benzínov s dodatočnou premenou produktov
[upraviť | upraviť zdroj]- CnH2n + 2 → 2 C2H2 + CmH2m
Využitie etínu
[upraviť | upraviť zdroj]Používa sa ako technický plyn pri rôznych chemických procesoch a ako palivo do plynových zváračiek a karbidových lámp; zmes acetylénu s kyslíkom horí plameňom s teplotou až 3000 °C.[1] Pri jeho spaľovaní dochádza ku trom rôznym reakciám podľa množstva kyslíka vstupujúceho do reakcie.
- 2 C2H2 + O2 → 4 C + 2 H2O
- 2 C2H2 + 3 O2 → 4 CO + 2 H2O
- 2 C2H2 + 5 O2 → 4 CO2 + 2 H2O
Rozpoznať reakciu je možné podľa teploty plameňa a produkcie sadzí.
V minulosti bol acetylén hlavnou surovinou na výrobu alifatických uhľovodíkov, dnes slúži predovšetkým na výrobu vinyléterov a esterov, 1,4-butándiolu.[1]
Upozornenie
[upraviť | upraviť zdroj]Acetylén je síce netoxický, ale pri vyššej koncentrácii ma po vdýchnutí dusivé a mierne narkotické účinky. Pri tlaku prevyšujúcom 150 kPa (neoverené) alebo privedení do kvapalného alebo tuhého skupenstva samovoľne exploduje. Kvôli tomuto nepríjemnému javu sa vo vysokotlakových nádobách skladuje rozpustený v acetóne.
Referencie
[upraviť | upraviť zdroj]- ↑ a b c d e aetylén. In: Encyclopaedia Beliana. 1. vyd. Bratislava : Encyklopedický ústav SAV; Veda, 1999. 696 s. ISBN 80-224-0554-X. Zväzok 1. (A – Belk), s. 38.
- ↑ Technické plyny [online]. [Cit. 2012-08-16]. Dostupné online. (česky)
Externé odkazy
[upraviť | upraviť zdroj]- Údaje o acetyléne Archivované 2005-08-08 na Wayback Machine (po anglicky)