Damptrykk

Damptrykket er det trykket som en gass av et stoff utøver når den er i termodynamisk likevekt med det samme stoffet i fast eller flytende form.
Når en væske lukkes inne i et tett kammer, vil noe av væsken fordampe ved at molekyler river seg løs og går over i gassform, og det oppstår en utveksling av molekyler mellom gass og væske, inntil det er en likevekt, slik at det pr. tidsenhet går like mange molekyler den ene som den andre vegen. Det trykket gassen har på dette stadiet, kalles metningstrykket eller likså godt bare damptrykket for vedkommende stoff ved den gitte temperaturen. Trykk som måles før metning inntreffer, omtales oftest som gasstrykk.
Hvis væsken varmes opp, vil mer stoff fordampe og damptrykket stiger. Blir dette like stort som lufttrykket, vil væsken koke. Metningstrykket for vanndamp i luft er i praksis uavhengig av tilstedeværelsen av de andre komponentene som oksygen og nitrogen. Øker vanndampens trykk, må partialtrykkene fra disse andre komponentene avta for at det totale lufttykket skal forbli det samme.
Et flytende stoff som har et høyt damptrykk ved normal temperatur, omtales ofte som flyktig. Hvis en slik væske fortynnes, vil dens damptrykk reduseres som beskrevet ved Raoults lov. På samme måte vil en væske som består av flere flyktige komponenter, gi opphav til en damp som er en blanding av de samme komponentene. Partialtrykket til hver av dem er gitt ved en utvidet form av Raoults lov.
Også faste stoff har et damptrykk. Det kan defineres som gasstrykket som oppstår når sublimasjon og avsetning (deposisjon) er i likevekt. For de aller fleste faste stoff er gasstrykket svært lavt og vanskelig å måle. Ett viktig unntak er is.
Termodynamikk
[rediger | rediger kilde]
Når dampen er i termodynamisk likevekt med flytende vann, vil like mange vannmolekyler forlate vannet og gå over i dampen som det antallet som returnerer til vannet. Ved større trykk enn metningstrykket vil dampen begynne å kondensere til vann hvis temperaturen holdes uforandret.[1]
Trykket til dampen bestemmes av antall vannmolekyler som befinner seg i gassfasen. Øker temperaturen, vil mer vann fordampe slik at trykket i dampen øker. Denne sammenhengen kan beregnes ved bruk av termodynamikk. I likevekt er både temperaturen og det kjemiske potensialet det samme i den flytende som i den gassformige fasen av vannet. Det kan benyttes til å utlede Clausius-Clapeyrons ligning for damptrykket som funksjon absolutt temperatur . Så lenge temperaturen er godt under den kritiske temperaturen, kan den skrives som
hvor er fordampningsvarmen som går med til å danne et volum med damp fra flytende vann. For at ligningen skal kunne løses, må man kjenne til hvordan fordampningsvarmen varierer med temperaturen. Likedan må man kjenne tilstandsligningen for dampen som sier hvordan dens volum varierer med trykk og temperatur.
Dampen kan på enkleste vis beskrives ved tilstandsligningen for en ideell gass. For 1 mol med damp er da . Da vil som kan skrives som
Kjenner man til hvordan fordampningsvarmen varierer med temperaturen, kan man herfra finne hvordan logaritmen til metningstrykket varierer.
August-ligningen
[rediger | rediger kilde]Hvis man betrakter en liten temperaturforandring, vil fordampningsvarmen tilnærmet forbli konstant. Direkte integrasjon gir da
hvor er en referansetemperatur der trykket er . For vann kan man velge kokepunktet der Kelvin og hPa som tilsvarer temperaturen 100 °C og atmosfæretrykket 1 atm. Denne formelen gir da trykket = 0.7 atm i vanndamp ved 90 °C ved bruk av verdien R = 8.31 J/mol K for gasskonstanten og Lv = 40.7 kJ/mol for fordampningsvarmen ved kokepunktet,

Med disse antagelsene varier damptrykket med temperaturen ifølge formelen
hvor A og B er konstanter. Denne ligningen ble først foreslått av den tyske fysikeren Ernst Ferdinand August på midten av det 1800-tallet og bærer derfor vanligvis hans navn.[2]
Den kan gjøres mer nøyaktig ved å ta med et temperaturavhengig ledd i fordampningsvarmen. Er denne variasjonen lineær, kan man skrive denne som Lv = a + bT hvor a og b er konstanter. Integrasjon av Clausius-Clapeyrons ligning gir da damptrykksformelen
Tilsvarende forbedringer av August-ligningen kan finnes for andre temperaturvariasjoner av fordampningsvarmen. Dette gir et resultat som noen ganger går under navnet DIPPR101-ligning.[1] For vanndamp er den mest nøyaktige formel for metningstrykket gitt ved Goff-Gratch-ligningen hvor også antagelsen om dampen som ideell gass er erstattet med en mer realistisk beskrivelse.
Empiriske formler
[rediger | rediger kilde]I stedet for å utlede en nøyaktig formel for damptrykket direkte fra termodynamikk, kan man også etablere empiriske formler som følger fra direkte målinger. En av de enkleste er Antoine-formelen som ble etablert på slutten av 1800-tallet. Den fremkommer ved et skifte av temperaturen i August-formelen. På den måten oppstår den modifiserte ligningen
For vanndamp under 100 °C er typiske verdier for de tre konstantene A = 5.11, B = 1688 K og C = - 43 K. Denne Antoine-formelen har da en nøyaktighet på bedre enn 3% i det samme intervallet.[2]
Antoine-formelen kan betraktes som en omskrivning av den tidligere etablerte Magnus-formelen for vanndamp. Det sees ved å måle temperaturen i celsius-grader θ slik at man kan sette T = θ + 273. På den måten kommer man frem til det alternative uttrykket
hvor θC = 273 + C og A' = A - ln (P0/Pst). Dermed er P0 damptrykket ved θ = 0 °C. For vanndamp er de anbefalte verdiene A' = 17.6, θC = 243 °C og P0 = 611 Pa.[3] Denne formelen ble funnet av den eksperimentelle fysiker Gustav Magnus i den første halvdel av 1800-tallet.
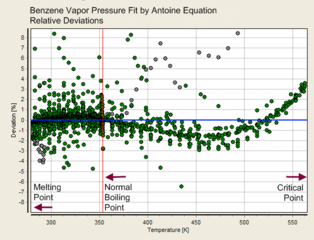
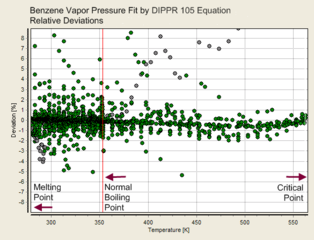
Desto flere parametre ligningen for damptrykket inneholder, desto mer nøyaktig vil den være. Dette kan illustreres med måledata for benzen i figurene under.
- Nøyaktighet av de forskjellige formlene for benzen:
-
August-ligning (2 parametre)
-
Antoine-ligning (3 parametre)
-
DIPPR101-ligning (4 parametre)
Metningstrykket for vanndamp kan også beregnes med overraskende god nøyaktighet fra den rent empiriske og enkle formelen
som kan benyttes helt opp til det kritiske punktet for vann ved 374 °C. Her er igjen referansetrykket Pst = 1 atm.[4]
Referanser
[rediger | rediger kilde]- ^ a b R. Müller, Thermodynamik: Vom Tautropfen zum Solarkraftwerk, Walter de Gruyther GmbH, Berlin (2014). ISBN 978-3-11-030198-4.
- ^ a b B.E. Poling, J.M. Prausnitz and J.P. O'Connell, The Properties of Gases and Liquids, McGraw-Hill, New York (2001). ISBN 0-070-116822.
- ^ M.G. Lawrence, The Relationship between Relative Humidity and the Dewpoint Temperature in Moist Air, Bulletin of the American Meteorological Society 86, 225-233 (2005).
- ^ S. Skogestad, Chemical and Energy Process Engineering, CRC Press (Taylor & Francis Group), New York (2009). ISBN 978-1420087550.
Litteratur
[rediger | rediger kilde]- E. Lillestøl, O. Hunderi og J.R. Lien, Generell Fysikk, Bind 2, Universitetsforlaget, Oslo (2001). ISBN 82-15-00006-1.
- R. Müller, Thermodynamik: Vom Tautropfen zum Solarkraftwerk, Walter de Gruyther GmbH, Berlin (2014). ISBN 978-3-11-030198-4.
- P.A. Rock, Chemical Thermodynamics, University Science Books, Oxford (1983). ISBN 0-19-855712-5.