Prion
| Prionziekten | ||||
|---|---|---|---|---|
| ||||
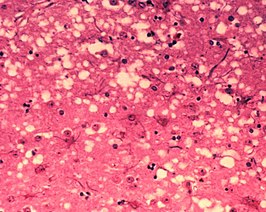
Weefsels die getroffen zijn door prionen vertonen een karakteristieke sponsachtige structuur
| ||||
| Classificatie | ||||
| Specialisme | Infectieziekten | |||
| ||||
Een prion is een verkeerd gevouwen eiwit dat bij mens en dier ernstige neurodegeneratieve ziekten kan veroorzaken. Prionen kunnen hun verkeerde ruimtelijke structuur doorgeven aan andere, goed gevouwen eiwitten. Hierdoor kunnen eiwitklonteringen ontstaan die schadelijk zijn voor de functie van cellen en van het organisme. Enkele nauw verwante hersenziekten – de ziekte van Creutzfeldt-Jakob in mensen, scrapie in schapen en boviene spongiforme encefalopathie in runderen – worden veroorzaakt door een verkeerd gevouwen, geaggregeerde vorm van PrP (een prion-eiwit).
Prionen zijn overdraagbaar tussen diersoorten door opname via het voedsel. Prionen gedragen zich hierdoor als ziekteverwekkers zoals bacteriën of virussen, hoewel ze geen apart genetisch materiaal bevatten.
Achtergrond
[bewerken | brontekst bewerken]Eiwitten bestaan uit ketens van aminozuren die opgevouwen zijn. Bij een prion is deze eiwitvouwing abnormaal verlopen en het resulterende deeltje kan niet zoals normale eiwitten worden afgebroken door eiwitafbrekende enzymen (proteasen). Bij contact met de normale versie van het eiwit zetten ze dit normale eiwit bovendien aan om ook over te gaan tot abnormale vouwing. Hierdoor ontstaat een kettingreactie in de cel waarbij uiteindelijk alle moleculen van dat eiwit in de abnormale, niet-functionele configuratie verkeren. Hierdoor gaan aangetaste zenuwcellen uiteindelijk dood, waardoor zieke dieren neurologische verschijnselen gaan vertonen en uiteindelijk ook doodgaan. Het is nog onzeker of de dieren sterven door het wegvallen van de werking van het correcte eiwit of door de werking van de foute eiwitten.
De benaming prion komt van proteinaceous infectious particles oftewel eiwitachtige ziekmakende deeltjes.
Prionproteïne-gen en ziekten
[bewerken | brontekst bewerken]Het normale eiwit PrPc wordt gecodeerd door het PRNP-gen (het prionproteïne-gen), dat bij de mens gelegen is op chromosoom 20 (locus 20p13). Door mutaties van het gen PRNP kunnen er door kleine afwijkingen in de gevormde aminozuren prionen (bij scrapie: PrPSc) gevormd worden. In deze gevallen kan de ziekte erfelijk zijn. De schapenfokkerij is bezig om de schapen genetisch scrapievrij te maken. Vanaf oktober 2004 mogen in Nederland alleen resistente (met het ARR/ARR genotype) dekrammen gebruikt worden met als doel het fokken van scrapie-ongevoelige schapen. In 2006 is door genetische manipulatie een koe gemaakt die niet het eiwit heeft waaruit het prion ontstaat. Deze lijkt zich verder normaal te ontwikkelen en inderdaad niet vatbaar te zijn voor BSE.[1]
Lange tijd zijn de prionziekten een groot raadsel geweest: bij experimenten bleken de ziekten overdraagbaar te zijn, waardoor ze tot de infectieziekten konden worden gerekend, maar het veroorzakende agens was kleiner dan welke bacterie of welk virus ook. Het exacte werkingsmechanisme is tot op heden niet helemaal opgehelderd.
Ontdekking
[bewerken | brontekst bewerken]De Amerikaanse onderzoeker Stanley B. Prusiner kwam in 1982 voor het eerst met zijn nieuwe infectieprincipe op de proppen en lanceerde de term ‘prion’, een samentrekking voor proteinaceous infectious particle. Hij ontving hiervoor in 1997 een Nobelprijs voor de geneeskunde. Hij beweerde dat bepaalde eiwitten in het lichaam verantwoordelijk waren voor enkele tot dan toe onbegrijpelijke ziekten. Het was de grootste doorbraak in de medische microbiologie van de 20e eeuw want het ging tegen alle gevestigde opvattingen in; men ging er namelijk nog steeds van uit dat alle infectieziekten veroorzaakt worden door ziekteverwekkende micro-organismen. Deze "klassieke" ziekteverwekkers bevatten allemaal DNA of RNA dat de genetische codes bevat van deze pathogenen en dat nodig is om te kunnen voortplanten.
Een prionziekte wordt veroorzaakt doordat een normaal eiwit in de hersencellen wordt omgevormd tot een abnormaal eiwit. Het normale eiwit heeft een functie in het biologische ritme, het draagt boodschappen over tussen cellen en wordt in principe na gebruik door de enzymen van de hersencellen afgebroken. Om nog onbekende redenen verandert het eiwit soms van structuur, waarna het een ravage aanricht in het zenuwstelsel. Zo’n infectieus eiwit of prion is namelijk ook in staat normale eiwitten om te vormen tot abnormale en schadelijke exemplaren. De aanwezigheid van deze schadelijke prionen vinden we terug in de hersenen en alle zenuwcellen van besmette dieren en kunnen bij opstapeling leiden tot het afsterven van de zenuwcellen. Verhitting tot 100 graden Celsius en ook autoclaveren (steriliseren onder verhoogde druk) is niet voldoende om prionen af te breken en onschadelijk te maken.
Vaccin
[bewerken | brontekst bewerken]Aan de Universiteit van Calgary wordt er gewerkt aan een vaccin om de verspreiding onder herten te voorkomen[2].
Prionziekten
[bewerken | brontekst bewerken]Bij verschillende diersoorten en de mens zijn inmiddels een aantal prionziekten bekend, waarvan de bekendste zijn:
- Mens
- Kuru, ontdekt bij een Papoeastam in Nieuw-Guinea die hersenweefsel eten
- Ziekte van Creutzfeldt-Jakob
- Syndroom van Gerstmann-Sträussler-Scheinker (GSS)
- FFI (dodelijke slapeloosheid)
- Groeihormoon-deficiëntie werd ooit behandeld met groeihormoon afkomstig uit menselijke hypofyses van (zeer veel) overledenen. Ook hier viel het op dat veel vroegere patiënten een BSE-achtige ziekte kregen. Tegenwoordig wordt groeihormoon gemaakt via recombinant-DNA-technieken.
- Hertachtigen
- Chronic wasting disease (CWD) , wordt ook "Zombie deer disease" genoemd. Ook mensen zijn kwetsbaar[3]
- Rund
- Boviene spongiforme encefalopathie (BSE of gekkekoeienziekte)
- Schaap
- Scrapie of schuurziekte
- Nerts
- Overdraagbare nerts-encefalopathie
- Kat
- Feliene spongiforme encefalopathie
- ↑ Richt J.A., et al., (2007) Production of cattle lacking prion protein. Nat Biotechnol. Jan. 25(1):132-8.
- ↑ (en) UCalgary researchers at work on a vaccine against a fatal infectious disease affecting deer and potentially people. News (16 juli 2021). Geraadpleegd op 30 juli 2021.
- ↑ (fr) Suspension provisoire des travaux sur les prions dans les laboratoires de recherche publics français. INRAE Institutionnel. Geraadpleegd op 30 juli 2021.
