Kegelhoek
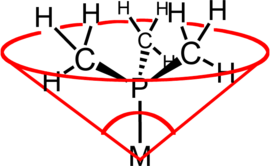
Het begrip kegelhoek of, in het Engels, ligand cone angle (afgekort tot LCA) is een maat voor de grootte van een ligand. Wanneer het ligand binnen een denkbeeldige omgeschreven kegel geplaatst wordt, is de kegelhoek de tophoek van deze denkbeeldige kegel.
De kegelhoek werd geïntroduceerd door Chadwick A. Tolman en voor het eerst toegepast bij tertiaire fosfineliganden. De hoek werd in eerste instantie bepaald door nauwkeurige metingen aan modellen van de liganden.[1][2][3]
Asymmetrische liganden
[bewerken | brontekst bewerken]De kegelhoek is het eenvoudigst in te zien bij symmetrische liganden als de tertiaire fosfines (PR3). Het begrip is echter uitgebreid tot asymmetrische liganden (waarbij de R-groepen op fosfor verschillen van elkaar) en ook difosfines kunnen ermee beschreven worden. In zulke gevallen wordt de waarde van de kegelhoek berekend uit de kegelhoekwaarden voor de verschillende symmetrische liganden waaruit het gevormd kan worden. In het geval van de difosfines wordt een waarde van 74°, 85° of 90° genomen voor liganden met respectievelijk een methyleen-, ethyleen- of propyleenbrug.[4]
Verschillende manieren van meten
[bewerken | brontekst bewerken]De door Tolman gedefinieerde kegelhoek maakt gebruik van empirisch vastgestelde bindingslengtes en definieert de buitenste rand van de waterstofatomen als het maximale bereik van een vrij draaibare substituent. Daarnaast wordt ook gebruikgemaakt van de via kristallografische metingen verkregen bindingslengtes.[5][6]
Toepassingen
[bewerken | brontekst bewerken]Het concept heeft praktische betekenis in de homogene katalyse omdat de grootte van de substituent de reactiviteit van het metaalcentrum beïnvloedt. Een bekend voorbeeld hiervan is de selectiviteit die waargenomen wordt bij de hydroformylering. Vooral het feit dat fosfineliganden wel eenwaardig zijn, maar soms ook meer dan de helft van de coördinatieruimte rond een metaal kunnen bezetten, speelt hierbij een rol.[7]
Waarden voor kegelhoeken
[bewerken | brontekst bewerken]Onderstaande tabel geeft een overzicht van de kegelhoeken van enkele veelvoorkomende liganden.
| Ligand | Kegelhoek |
|---|---|
| Fosfine | 87°[1] |
| Fosfortrifluoride | 104°[1] |
| Trimethylfosfiet | 107°[1] |
| dmpe | 107° |
| Trimethylfosfine | 118°[1] |
| dppm | 121° |
| dppe | 125° |
| dppp | 127° |
| Tri-ethylfosfine | 132°[1] |
| dcpe | 142° |
| Trifenylfosfine | 145°[1] |
| Tricyclohexylfosfine | 179°[1] |
| Tri-tert-butylfosfine | 182°[1] |
| Trispentafluorfenylfosfine | 184°[1] |
| Trimesitylfosfine | 212° |
Zie ook
[bewerken | brontekst bewerken]- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Ligand cone angle op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ a b c d e f g h i j Chadwick A. Tolman. (1970). Phosphorus ligand exchange equilibriums on zerovalent nickel. Dominant role for steric effects J.Amer.Chem.Soc. 92 (10): pag.: 2956–2965 DOI:10.1021/ja00713a007
- ↑ C.A. Tolman, W.C. Seidel, L.W. Gosser. (1974). Formation of three-coordinate nickel(0) complexes by phosphorus ligand dissociation from NiL4 J.Amer.Chem.Soc. 96 (1): pag.: 53–60 DOI:10.1021/ja00808a009
- ↑ C.A. Tolman. (1977). Steric Effects of Phosphorus Ligands in Organometallic Chemistry and Homogeneous Catalysis Chem.Rev.. 77 (3): pag.: 313–348 DOI:10.1021/cr60307a002
- ↑ T.A. Manz, K. Phomphrai, G. Medvedev, B.B. Krishnamurthy, S. Sharma, J. Haq, K.A. Novstrup, K.T. Thomson, W.N. Delgass, J.M. Caruthers, M.M. Abu-Omar. (2007). Structure−Activity Correlation in Titanium Single-Site Olefin Polymerization Catalysts Containing Mixed Cyclopentadienyl/Aryloxide Ligation J.Amer.Chem.Soc. 129 (13): pag.: 3776–3777 DOI:10.1021/ja0640849
- ↑ A. Immirzi, A. Musco. (1977). A method to measure the size of phosphorus ligands in coordination complexes Inorganica Chimica Acta. 25 pag.: L41–L42 DOI:10.1016/S0020-1693(00)95635-4
- ↑ Tobias Niksch, Helmar Görls, Wolfgang Weigand. (2010). The Extension of the Solid-Angle Concept to Bidentate Ligands European Journal of Inorganic Chemistry. 2010 (1): pag.: 95–105 DOI:10.1002/ejic.200900825
- ↑ D. Evans, J.A. Osborn, G. Wilkinson. (1968). Hydroformylation of Alkenes by Use of Rhodium Complex Catalyst J.Chem.Soc.. 33 (21): pag.: 3133–3142 DOI:10.1039/J19680003133
