Chloorpentafluorethaan
Uiterlijk
| Chloorpentafluorethaan | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
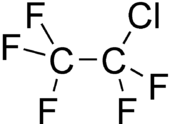
| ||||
Structuurformule van chloorpentafluorethaan
| ||||
| Algemeen | ||||
| Molecuulformule | C2ClF5 | |||
| IUPAC-naam | 1-chloor-1,1,2,2,2-pentafluorethaan | |||
| Andere namen | Freon 115, CFC-115, R-115 | |||
| Molmassa | 154,466416 g/mol | |||
| SMILES | C(C(F)(F)Cl)(F)(F)F
| |||
| InChI | 1S/C2ClF5/c3-1(4,5)2(6,7)8
| |||
| CAS-nummer | 76-15-3 | |||
| EG-nummer | 200-938-2 | |||
| PubChem | 6430 | |||
| Wikidata | Q419702 | |||
| Beschrijving | Kleurloos vloeibaar gemaakt gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H280 | |||
| EUH-zinnen | geen | |||
| P-zinnen | geen | |||
| VN-nummer | 1020 | |||
| ADR-klasse | Gevarenklasse 2.2 | |||
| MAC-waarde | 1000 ppm 6320 mg/m³ | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | (bij 0°C) 0,0071 g/cm³ | |||
| Smeltpunt | −106 °C | |||
| Kookpunt | −39 °C | |||
| Vlampunt | 70,4 °C | |||
| Dampdruk | (bij 20°C) 796.000 Pa | |||
| Oplosbaarheid in water | 0,059 g/L | |||
| Goed oplosbaar in | ethanol, di-ethylether, koolwaterstoffen, esters, ketonen en carbonzuren | |||
| Slecht oplosbaar in | water | |||
| Onoplosbaar in | glycol, glycerol en fenol | |||
| log(Pow) | 2,4 | |||
| C |
0,116 J/mol·K | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Chloorpentafluorethaan, ook bekend onder de naam Freon 115, is een gehalogeneerde organische verbinding, met als brutoformule C2ClF5. Het is een kleurloos en geurloos gas, dat quasi-onoplosbaar is in water. Het is niet toxisch en niet ontvlambaar, maar kan wel irritatie teweegbrengen.
Koelmiddel
[bewerken | brontekst bewerken]Chloorpentafluorethaan is een cfk dat gebruikt werd als koelmiddel. Sedert 1 januari 1996 is het door het Montréal-protocol verboden om nog in die context te gebruiken. Het wordt beschouwd als een schadelijke stof voor de ozonlaag (GWP-waarde van 7370).[1]
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Bij contact met een heet oppervlak of met een vlam ontleedt deze stof onder vorming van giftige dampen, waaronder waterstofchloride en waterstoffluoride (in aanwezigheid van water).
Externe links
[bewerken | brontekst bewerken]Bronnen, noten en/of referenties
- ↑ (en) P.P. Forster, V. Ramaswamy et al. (2007) - Changes in Atmospheric Constituents and in Radiative Forcing, Climate Change 2007: The Physical Science Basis, Cambridge University Press, Cambridge en New York, p. 212

