Chloordioxide
| Chloordioxide | |||||||
|---|---|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||||

| |||||||
Structuurformule van chloordioxide
| |||||||

| |||||||
Waterige oplossing van chloordioxide met daarboven het vrijwel zuivere gas
| |||||||
| Algemeen | |||||||
| Molecuulformule | ClO2 | ||||||
| IUPAC-naam | chloor(IV)oxide | ||||||
| Molmassa | 67,4518 g/mol | ||||||
| SMILES | O=Cl[O]
| ||||||
| InChI | 1S/ClO2/c2-1-3
| ||||||
| CAS-nummer | 10049-04-4 | ||||||
| EG-nummer | 233-162-8 | ||||||
| PubChem | 24870 | ||||||
| Wikidata | Q422080 | ||||||
| Beschrijving | Geel giftig gas | ||||||
| Vergelijkbaar met | dichloor | ||||||
| Waarschuwingen en veiligheidsmaatregelen | |||||||
| |||||||
| H-zinnen | H270 - H330 - H314 - H400 | ||||||
| EUH-zinnen | EUH006 | ||||||
| P-zinnen | geen | ||||||
| Omgang | Niet inademen, contact en blootstelling vermijden | ||||||
| EG-Index-nummer | 017-026-00-3 | ||||||
| MAC-waarde | 0,28 mg/m³ | ||||||
| LD50 (ratten) | (oraal) 292 mg/kg | ||||||
| Fysische eigenschappen | |||||||
| Aggregatietoestand | gasvormig | ||||||
| Kleur | geel | ||||||
| Dichtheid | 3,01 × 10−3[1] g/cm³ | ||||||
| Smeltpunt | −59[1] °C | ||||||
| Kookpunt | 11[1] °C | ||||||
| Oplosbaarheid in water | 7,5[1] g/L | ||||||
| Matig oplosbaar in | water, ethanol, zwavelzuur | ||||||
| Thermodynamische eigenschappen | |||||||
| ΔfH |
104,60 kJ/mol | ||||||
| S |
257,22 J/mol·K | ||||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||||
| |||||||
Chloordioxide is een anorganische verbinding van chloor en zuurstof, met als brutoformule ClO2. Bij kamertemperatuur is het een geel giftig en corrosief gas dat bij een temperatuur van −59 °C uitkristalliseert als oranje kristallen. Het is een van de oxiden van chloor en een van de weinige verbindingen waarin chloor het oxidatiegetal +IV bezit. De verbinding is een krachtige oxidator die toepassing vindt in de drinkwaterreiniging en als bleekmiddel.
Synthese
[bewerken | brontekst bewerken]Chloordioxide is een verbinding die explosief kan ontleden indien de stof geconcentreerd of geïsoleerd wordt. Bij de bereiding en het hanteren ervan wordt daarom meestal met verdunde preparaten gewerkt en vermeden dat het als gas vrijkomt.
Laboratoriumschaal
[bewerken | brontekst bewerken]In het laboratorium kan chloordioxide bereid worden door de oxidatie van natriumchloriet met chloorgas:[2]
Industriële productiemethode
[bewerken | brontekst bewerken]Meer dan 95% van het chloordioxide dat in de wereld wordt toegepast, wordt echter bereid uit natriumchloraat. De commerciële route omvat een reductie van waterstofchloraat met een geschikte reductor in sterk zure omgeving:
In de jaren 50 van de 20e eeuw werd hiertoe het Mathieson-proces ontwikkeld, waarbij zwaveldioxide als reductor wordt aangewend:
Het zwavelzuur wordt hier in overmaat gebruikt, omdat het de lage pH van de oplossing moet waarborgen. Om spontane ontleding of explosie te vermijden, wordt continu lucht door de oplossing geborreld. Het chloordioxide ontsnapt daarbij uit de oplossing en wordt vervolgens door gekoeld water geleid om in oplossing te gaan.
Naast zwaveldioxide kan ook waterstofchloride gebruikt worden, hoewel daarbij het nadeel is dat er aanzienlijke hoeveelheden chloorgas gevormd worden. Het proces verloopt in verschillende stappen:
Het gevormde waterstofchloriet reageert met het startproduct tot chloordioxide:
Waterstofhypochloriet ten slotte reageert met waterstofchloride, waarbij chloorgas gevormd wordt:
Om deze laatste nevenreactie te vermijden, wordt in plaats van waterstofchloride natriumchloride gebruikt:
Van deze methode bestaat een zogenaamde Solvay-variant, waarbij natriumchloride wordt vervangen door methanol als reductor, en mierenzuur wordt gevormd in plaats van chloorgas.
Overige methoden
[bewerken | brontekst bewerken]Chloordioxide kan bereid worden door een mengsel van natriumchloriet en natriumhypochloriet te behandelen met zoutzuur:
Erg zuiver chloordioxide kan vervaardigd worden door middel van elektrolyse van een natriumchlorietoplossing:
Elektronische structuur en bindingseigenschappen
[bewerken | brontekst bewerken]Oorspronkelijke beschrijving
[bewerken | brontekst bewerken]De molecule heeft een gebogen vorm met een bindingshoek van 117° en twee Cl-O-bindingen van gelijke lengte (147 pm). De elektronische structuur die het bindingsfenomeen verklaart heeft voor veel hoofdbrekens gezorgd. De molecule heeft in totaal 19 valentie-elektronen en omdat dit een oneven aantal is, is de molecule een paramagnetisch radicaal. Meestal zijn zulke entiteiten zeer reactief en men zou de vorming van een dimeer dichloortetraoxide (Cl2O4) kunnen verwachten. Ondanks de reactiviteit van chloordioxide wordt een dergelijke dimerisatie niet waargenomen.
Van chloordioxide is geen eenduidige Lewisstructuur neer te schrijven: er zijn een aantal mogelijkheden die echter niet erg bevredigend zijn. In 1933 stelde L.O. Brockway daarom een drie-elektronbinding voor.[3] Linus Pauling ontwikkelde dat idee verder en stelde een resonantie voor tussen twee structuren:[4]

Volgens Pauling verzwakt het extra ongepaard elektron de binding, waardoor deze zwakker is dan een dubbele binding. In feite betekent dit dat er gedacht moet worden aan een moleculair orbitaal dat zich over de drie atomen uitstrekt en waarvan de hoogste in energie niet geheel gevuld is.
Kwantummechanische beschrijving
[bewerken | brontekst bewerken]Onderstaand moleculair orbitaalschema toont de elektronische situatie zoals deze voor drie p-orbitalen en drie elektronen geldt:
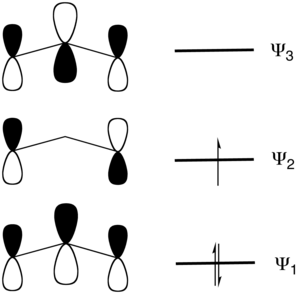
De zwakkere binding tussen de zuurstofatomen en chloor zijn het gevolg van de bindende interactie die zich in het laagste moleculaire orbitaal (ψ1) manifesteert. Aangezien er twee zuurstofatomen op chloor gebonden zijn is het gevolg dat telkens een van beide bindingen, zoals ook al door Linus Pauling werd gesuggereerd, zwakker is. Het tweede moleculaire orbitaal (ψ2) is half bezet en draagt niet bij aan de binding tussen chloor en de zuurstofatomen, omdat er zich een knoopvlak op chloor bevindt. Dit moleculair orbitaal, dat de HOMO van chloordioxide voorstelt, is half gevuld. Dit is ook experimenteel aangetoond met behulp van spectroscopische technieken.[5]
Toepassingen
[bewerken | brontekst bewerken]Chloordioxide wordt hoofdzakelijk (> 95%) toegepast voor het bleken van houtpulp en in mindere mate van bloem. Daarnaast werd het gebruikt als in desinfectiemiddel van drinkwater. In 1944 nam de drinkwaterreiniging van Niagara Falls het in gebruik om in water opgelost fenol te vernietigen. In 1956 stapte de stad Brussel over van chloor op chloordioxide voor de drinkwaterreiniging en daarmee begon de grootschalige toepassing. De stof wordt meestal gebruikt in een vooroxidatiestap om onzuiverheden te vernietigen die anders met chloor trihalogeenmethanen (zoals chloroform) zouden vormen. Deze stoffen zijn potentieel kankerverwekkend. Chloordioxide is ook beter dan chloor bij zuurtegraden boven pH 7 en in aanwezigheid van ammoniak en amines. Verder houdt het de vorming van een biofilm in waterleidingen beter onder controle. Chloordioxide wordt ook veel toegepast in industriële waterreiniging, in koeltorens en in voedselverwerking.
Chloordioxide is minder corrosief dan chloor en houdt de legionellabacterie beter onder de knie. Hetzelfde geldt voor andere ziektekiemen die door het water verspreid worden zoals virussen,[6] bacteriën en protozoa, waaronder de cysten van Giardia en de oocysten van Cryptosporidium.
Het gebruik in drinkwaterzuivering leidt echter wel tot de vorming van chlorieten als nevenproduct. In de Verenigde Staten is er een maximum gesteld van 1 ppm aan deze stof. De Amerikaanse EPA beperkt het gebruik van chloordioxide tot de bewerking van water van relatief hoge kwaliteit of water dat behandeld wordt met coagulanten op basis van ijzer (zoals ijzer(III)fosfaat). Het chloriet wordt namelijk daardoor tot chloride gereduceerd. In Nederland wordt sedert 2005 geen chloor meer gebruikt in drinkwaterzuivering.
De verbinding kan ook voor het ontsmetten van lucht gebruikt worden en is als zodanig ingezet bij de miltvuuraanval van 2001. Ook schimmels kunnen ermee bestreden worden. Dit werd toegepast in New Orleans na de watersnood veroorzaakt door orkaan Katrina.
Andere toepassingen zijn de vernietiging van fenol in afvalwater en de bestrijding van de zebra- en quaggamossel.
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Bij een gehalte van meer dan 10 vol% (LEL)[7] in lucht bij standaardomstandigheden ontleedt chloordioxide spontaan en explosief in de elementen waaruit het is opgebouwd. De ontledingsreactie wordt door blootstelling aan licht op gang gebracht. Dit betekent dat de stof nooit in zuivere of geconcentreerde vorm gebruikt of gehanteerd wordt.
Meestal wordt er gewerkt met oplossingen van het gas met een concentratie van 0,5 tot 10 gram per liter. De oplosbaarheid neemt toe bij lagere temperatuur. Voor concentraties boven 3 g/L is het gebruikelijk gekoeld water van 5 °C te gebruiken bij de opslag. In veel landen is het verboden de stof te vervoeren. Daarom wordt chloordioxide vaak in situ bereid.
Gestabiliseerd chloordioxide
[bewerken | brontekst bewerken]Er zijn een aantal producten op de markt onder de naam stabilized chlorine dioxide (SCD). De meeste van deze oplossingen bevatten geen chloordioxide, maar een gebufferde oplossing van natriumchloriet. Hieraan kan een zwak zuur toegevoegd worden om chloordioxide in situ te genereren.
Externe links
[bewerken | brontekst bewerken] chloordioxide - International Chemical Safety Card
chloordioxide - International Chemical Safety Card- Hesselink, T.L. MD.; "Mechanisms of Toxicity of Chlorine Dioxide Against Malarial Parasites - An Overview; 06/09/2007
- Katalytische generatie van chloordioxide
- ↑ a b c d (en) Gegevens van chloordioxide in de GESTIS-stoffendatabank van het IFA (geraadpleegd op 15 maart 2010)
- ↑ (en) R.I. Derby & W.S. Hutchinson (1953) – Chlorine(IV) Oxide, Inorganic Syntheses, IV, pp. 152-158
- ↑ (en) L.O. Brockway (1933) – The Three-Electron Bond in Chlorine Dioxide, Proc. Natl. Acad. Sci., 19 (3), pp. 303-307
- ↑ (en) L. Pauling (1988) – General Chemistry, Courier Dover Publications - ISBN 0486656225
- ↑ (en) R. Flesch, J. Plenge & E. Rühl (2006) – Core-level excitation and fragmentation of chlorine dioxide, International Journal of Mass Spectrometry, 249-250, pp. 68-76
- ↑ Protective effect of low-concentration chlorine dioxide gas against influenza A virus infection Ogata N, Shibata T. J Gen Virol 89 (2008), 60-67; DOI 10.1099/vir.0.83393-0 https://web.archive.org/web/20090201072008/http://vir.sgmjournals.org/cgi/content/abstract/89/1/60
- ↑ Gestis substance database. Gearchiveerd op 4 maart 2022. Geraadpleegd op 4 maart 2022.















