Broomthymolblauw
| Broomthymolblauw | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
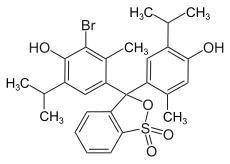
Structuurformule van broomthymolblauw
| ||||

| ||||
De kleur van broomthymolblauw in een zure (geel), neutrale (groen) en basische oplossing (blauw)
| ||||
| Algemeen | ||||
| Molecuulformule | C27H28Br2O5S | |||
| IUPAC-naam | 2-broom-4-[3-(3-broom-4-hydroxy-2-methyl-5-propan-2-ylfenyl)-1,1-dioxobenzo[c]oxathiol-3-yl]-3-methyl-6-propan-2-ylfenol | |||
| Andere namen | dibroomthymol-sulfoftaleïne | |||
| Molmassa | 624,38122 g/mol | |||
| SMILES | CC1=C(C(=C(C=C1C2(C3=CC=CC=C3S(=O)(=O)O2)C4=CC(=C(C(=C4C)Br)O)C(C)C)C(C)C)O)Br
| |||
| InChI | 1/C27H28Br2O5S/c1-13(2)17-11-20(15(5)23(28)25(17)30)27(19-9-7-8-10-22(19)35(32,33)34-27)21-12-18(14(3)4)26(31)24(29)16(21)6/h7-14,30-31H,1-6H3
| |||
| CAS-nummer | 76-59-5 | |||
| PubChem | 6450 | |||
| Wikidata | Q407506 | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,25 g/cm³ | |||
| Smeltpunt | 202 °C | |||
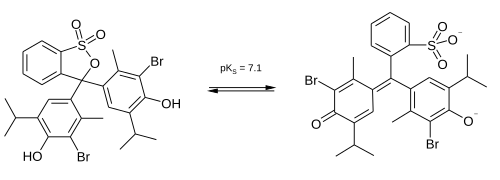
| Evenwichtsconstante(n) | pKa = 7,10 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Broomthymolblauw (soms broomthymol, dibroomthymolsulfonfhaleïne of BTB genoemd) is een trifenylmethaankleurstof die gebruikt wordt als indicator bij de titraties van zwakke zuren en basen. De verbinding wordt ook gebruikt bij het bestuderen van de fotosynthese en de celademhaling. In het eerste geval verkleurt de verbinding van geel naar blauw (koolstofdioxide verdwijnt), in het tweede geval van blauw naar geel (als koolstofdioxide vrijkomt in een reactie). Commercieel is het beschikbaar als het natriumzout van de indicator. Soms wordt het in het biologisch of biochemisch laboratorium gebruikt als kleurstof.
Structuur en eigenschappen
[bewerken | brontekst bewerken]Broomthymolblauw gedraagt zich in oplossingen als een zwak zuur. Het kan dus zowel geprotoneerd (geel) als gedeprotoneerd (blauw) voorkomen. In neutrale oplossingen (het omslaggebied van broomthymolblauw) is de stof groen.
Broomthymolblauw wordt vooral gebruikt voor het meten van de pH van zwak zure, neutrale en zwak basische oplossingen. De controle van de pH in aquaria of visvijvers is hier een duidelijk voorbeeld van.
Een groene oplossing van BTB kan geel gemaakt worden door er met een rietje in te blazen. De koolstofdioxide in de uitgeademde lucht laat de oplossing van groen naar geel verkleuren.
Rond een pH van 7,1 treedt een structurele overgang op in de molecule, hetgeen een kleurverandering tot gevolg heeft: