Жива(II) сулфат
| |
Други називи Жива сулфат, Жива-персулфат, Бисулфат жива[1] | |
| Назнаки | |
|---|---|
| 7783-35-9 | |
| ChemSpider | 22950 |
| EC-број | 231-992-5 |
| |
| 3Д-модел (Jmol) | Слика |
| PubChem | 24544 |
| RTECS-бр. | OX0500000 |
| |
| UNII | J4L3PPG58I |
| ОН-бр. | 1645 |
| Својства | |
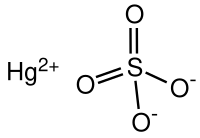
| Хемиска формула | |
| Моларна маса | 0 g mol−1 |
| Изглед | бели моноклинични кристали |
| Мирис | без мирис |
| Густина | 6.47 g/cm3, solid |
| 450 °C[2] | |
| Во вода се распаѓа до жолта жива субсулфат и сулфурна киселина | |
| Растворливост | растворлив во топол раствор на H2SO4, NaCl нерастворлив во етанол, ацетон, aмонијак |
| −78.1·10−6 cm3/mol | |
| Структура | |
| Кристална структура | ромпска |
| Термохемија | |
| Ст. енталпија на образување ΔfH |
−707.5 kJ mol−1[3] |
| Опасност | |
| GHS-ознаки:[4] | |
Пиктограми
|
  
|
Сигнални зборови
|
Опасност |
Изјави за опасност
|
H300, H310, H330, H373, H410 |
Изјави за претпазливост
|
P260, P262, P264, P270, P271, P273, P280, P284, P301+P316, P302+P352, P304+P340, P316, P319, P320, P321, P330, P361+P364, P391, P403+P233, P405, P501 |
| NFPA 704 | |
| Дополнителни податоци | |
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |
| Наводи | |
Жива(II) сулфат, вообичаено наречен жива сулфат, е хемиско соединение со формула HgSO4. Тоа е цврста материја без мирис која формира бели гранули или кристален прав. Во вода се одвојува во нерастворлив сулфат со жолта боја и сулфурна киселина.[3]
Структура
[уреди | уреди извор]
Анхидридната форма содежив Hg2+во високо искривена тетраедарна HgO4 средина. Двете растојанија на Hg-O се 2,22 А, а другите се 2,28 и 2,42 А.[5] Во монохидратот, Hg2+ усвојува линеарна координативна геометрија со должина на врските Hg-O (сулфат) и Hg-O (вода) од 2,179 и 2,228 Å, соодветно. Забележани се и четири послаби врски со Hg---O растојанија >2,5 Å.[6]
Историја
[уреди | уреди извор]Во 1932 година, јапонската хемиска компанија Chisso Corporation започнала да користи жива сулфат како катализатор за производство на ацеталдехид од ацетилен и вода. Иако во тоа време било непознато, метилживата се формира како несакан производ на оваа реакција. Изложеноста и потрошувачката на отпадните производи од жива, вклучително и метилживата, кои биле фрлени во заливот Минамата од Чисо се верува дека се причина за болеста Минамата во Минамата, Јапонија..[7]
Продукција
[уреди | уреди извор]Жива сулфатот може да се произведе со третирање на жива со топла концентрирана сулфурна киселина:[8]
- Hg + 2 H2SO4 → HgSO4 + SO2 + 2 H2O
Алтернативно, жолтиот живин оксид реагира и со концентрирана сулфурна киселина.[9]
Употреба
[уреди | уреди извор]Реагенс на Denigés
[уреди | уреди извор]Киселиот раствор на жива сулфат е познат како Denigés реагенс. Најчесто се користел во текот на 20 век како реагенс за квалитативна анализа. Ако Denigés' реагенсот се додава во раствор кој содржи соединенија кои имаат терцијарни алкохоли, ќе се формира жолт или црвен талог.[10]
Продукција на ацелалдехид
[уреди | уреди извор]Како што беше споменато претходно, Hg S O4 се користи како катализатор за производство на ацеталдехид од ацетилен и вода.[11]
Оксимеркурација-демеркурација на алкени
[уреди | уреди извор]Соединенијата на жива како жива сулфат и жива(II) ацетат најчесто се користат како катализатори во оксимеркурацијата-демеркурација, тип на реакција на електрофилно додавање. Хидратацијата на алкен резултира со алкохол што ја следи региоселективноста што е предвидена со Марковниковото правилото.
Хидратација на алкини
[уреди | уреди извор]Шемата за реакција е дадена подолу. Конверзија на 2,5-диметихексин-2,5-диол во 2,2,5,5-тетраметилт-трахидрофуран користејќи воден жива сулфат без додавање киселина.[12]

Здравствени проблеми
[уреди | уреди извор]Инхалацијата на HgSO4 може да резултира со акутно труење: предизвикување стегање во градите, отежнато дишење, кашлање и болка. Изложеност на HgSO4 во очите може да предизвикаат улцерации на конјунктивата и рожницата. Ако живата сулфат е изложена на кожата, може да предизвика сензибилизирачки дерматитис. И на крај, ингестијата на жива сулфат ќе предизвика некроза, болка, повраќање и сериозно прочистување. Голтањето може да резултира со смрт во рок од неколку часа поради периферен васкуларен колапс.[1]
Жива сулфатот се користел кон крајот на 19 век за да предизвика повраќање од медицински причини. [1]
Наводи
[уреди | уреди извор]- ↑ 1,0 1,1 „Chemicalbook“. Посетено на 2 May 2011.
- ↑ Wu, Shengji; Uddin, Md. Azhar; Nagano, Saori; Ozaki, Masaki; Sasaoka, Eiji (2011). „Fundamental Study on Decomposition Characteristics of Mercury Compounds over Solid Powder by Temperature-Programmed Decomposition Desorption Mass Spectrometry“. Energy & Fuels. 25 (1): 144–153. doi:10.1021/ef1009499.
- ↑ 3,0 3,1 Lide, David R. (1998). Handbook of Chemistry and Physics (87. изд.). Boca Raton, Florida: CRC Press. стр. 5–19. ISBN 0-8493-0594-2.
- ↑ „Mercuric sulfate“. pubchem.ncbi.nlm.nih.gov (англиски).
- ↑ Aurivillius, Karin; Stålhandske, Claes (1980). „A Reinvestigation of the Crystal Structures of HgSO4 and CdSO4“. Zeitschrift für Kristallographie - Crystalline Materials. 153 (1–2): 121–129. Bibcode:1980ZK....153..121A. doi:10.1524/zkri.1980.0011.
- ↑ Stålhandske, C. (1980). „An X-ray and Neutron Diffraction Study of Mercury(II) Sulphate Monohydrate“. Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. 36: 23–26. doi:10.1107/s0567740880002361.
- ↑ Minamata Disease Архивирано на 13 ноември 2019 г.. Boston University. Retrieved 2016-11-10.
- ↑ Simon, Matthias; Jönk, Peter; Wühl-Couturier, Gabriele; Halbach, Stefan (2006). „Mercury, Mercury Alloys, and Mercury Compounds“. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a16_269.pub2. ISBN 3527306730.
- ↑ Robey, R. F.; Robertson, N. C. (May 1947). „Test for tert-Butyl and Isopropyl Alcohols with Deniges Reagent“. Analytical Chemistry. 19 (5): 310–311. doi:10.1021/ac60005a007.
- ↑ Marks, E. M.; Lipkin, D. (1939). „Reaction of Aliphatic Ethers with Denigés' Reagent“. J. Org. Chem. 3 (6): 598–602. doi:10.1021/jo01223a008.
- ↑ Vogt, R; Nieuwland, J (September 1921). „The role of mercury salts in the catalytic transformation of acetylene into acetaldehyde, and a new commercial process for manufacture of paraaldehyde“. J. Am. Chem. Soc. 43 (9): 2071–81. doi:10.1021/ja01442a010.
- ↑ Wasacz, J. P.; Badding, V. G. (1982). „A hydration of an alkyne illustrating steam and vacuum distillation“. Journal of Chemical Education. 59 (8): 694. Bibcode:1982JChEd..59..694W. doi:10.1021/ed059p694.
Надворешни врски
[уреди | уреди извор]| „Жива(II) сулфат“ на Ризницата ? |
- National Pollutant Inventory – Mercury and compounds Fact Sheet
- NIOSH Pocket Guide to Chemical Hazards
| ||||||||||||||||
| ||||||||||||||||||||||||||||

