카복실화
카복실화(영어: carboxylation)는 기질을 이산화 탄소와 반응시켜 카복실기를 생성하는 화학 반응이다.[1] 카복실화 반응을 촉매하는 효소를 카복실화효소(영어: carboxylase)라고 한다. 카복실화의 반대되는 반응은 탈카복실화이다. 화학에서 탄산화라는 용어는 때때로 카복실화와 동의어로 사용되며, 특히 탄소 음이온 시약과 CO2의 반응에서 사용된다. 보다 일반적으로 탄산화는 보통 탄산염의 생성을 나타낸다.[2]
유기화학
[편집]카복실화는 유기화학에서 표준적인 전환 과정이다.[3] 특히 그리냐르 시약과 유기 리튬 화합물의 탈카복실화는 유기 할로젠화물을 카복실산으로 전환시키는 고전적인 방법이다.[4]
아스피린의 전구체인 살리실산 나트륨은 석탄산 나트륨(페놀의 나트륨 염)을 고온(390 K), 고압(100 기압)에서 이산화 탄소로 처리하여 상업적으로 제조된다. 이 방법은 콜베-슈미트 반응으로 알려져 있다. 생성된 살리실산염의 산성화로 살리실산이 생성된다.
 |
많은 상세한 절차가 《유기 합성》(Organic Syntheses) 저널에 설명되어 있다.[5][6][7]
카복실화에 관여하는 촉매에는 N-헤테로고리 카벤[8] 및 은을 기반으로 하는 촉매가 있다.[9]
생화학에서의 카복실화
[편집]탄소 기반의 생명체는 대기 중의 이산화 탄소를 당과 결합시키는 카복실화에서 비롯한다. 이 과정은 일반적으로 루비스코에 의해 촉매된다. 이러한 카복실화 반응을 촉매하는 효소인 루비스코(리불로스 1,5-이중인산 카복실화효소/산소화효소)는 아마도 지구 상에서 가장 풍부하게 존재하는 단일 단백질이다.[10][11][12]
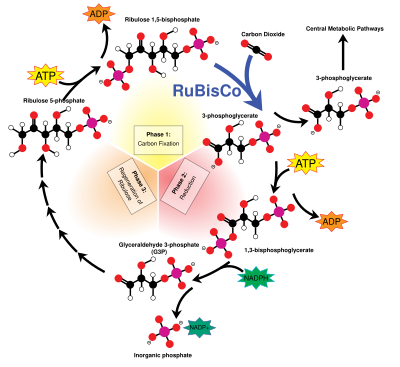 |

아세틸-CoA 카복실화효소, 메틸크로토닐-CoA 카복실화효소, 프로피오닐-CoA 카복실화효소, 피루브산 카복실화효소를 포함한 많은 카복실화효소들은 보조 인자로 비오틴을 필요로 한다. 이들 효소는 생체 내에서 다양한 대사 경로에 관여한다.[13] EC 번호 분류 체계에서 카복실화효소는 촉매하는 반응에 따라 분해효소(EC 4) 또는 연결효소(EC 6)로 분류된다.
또 다른 예로는 단백질에서 글루탐산 잔기를 카복시글루탐산으로 전환시키는 번역 후 변형이 있다. 이는 주로 혈액 응고 캐스케이드에 관여하는 단백질들, 특히 혈액 응고인자 II, VII, IX, X, 단백질 C, 단백질 S, 일부 뼈 단백질에서 일어난다. 이러한 변형은 이들 단백질이 기능하는 데 필요하다. 카복실화는 간에서 일어나며, γ-글루타밀 카복실화효소에 의해 촉매된다.[14] γ-글루타밀 카복실화효소는 보조 인자로 비타민 K를 필요로 한다.[15] 카복시글루탐산은 활성에 필수적인 칼슘과 결합한다.[16] 예를 들어 프로트롬빈에서 칼슘 결합은 단백질이 혈소판의 원형질막과 결합하여 손상 후에 프로트롬빈을 활성 트롬빈으로 절단하는 단백질과 밀접하게 연결되도록 한다.[17]
같이 보기
[편집]각주
[편집]- ↑ "Carboxylation: The introduction of a carboxyl group into a molecule or compound to form a carboxylic acid or a carboxylate; an instance of this."《Oxford English Dictionary》. Oxford University Press. 2018.
- ↑ "Carbonation: Impregnation or treatment with carbon dioxide; conversion into a carbonate."《Oxford English Dictionary》. Oxford University Press. 2018.
- ↑ Braunstein, Pierre; Matt, Dominique; Nobel, Dominique (August 1988). “Reactions of Carbon Dioxide with Carbon-Carbon Bond Formation Catalyzed by Transition-Metal Complexes”. 《Chemical Reviews》 88 (5): 747–764. doi:10.1021/cr00087a003.
- ↑ A. M. Appel; 외. (2013). “Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation”. 《Chem. Rev.》 113 (8): 6621–6658. doi:10.1021/cr300463y. PMC 3895110. PMID 23767781.
- ↑ Akira Yanagisawa; Katsutaka Yasue; Hisashi Yamamoto (1997). “Regio- and Stereoselective Carboxylation of Allylic Barium Reagents: (E)-4,8-Dimethyl-3,7-Nonadienoic Acid”. 《Organic Syntheses》 74: 178. doi:10.15227/orgsyn.074.0178.
- ↑ H. Koch; W. Haaf (1964). “1-Adamantanecarboxylic Acid”. 《Organic Syntheses》 44: 1. doi:10.15227/orgsyn.044.0001.
- ↑ W. Haaf (1966). “1-Methylcyclohexanecarboxylic Acid”. 《Organic Syntheses》 46: 72. doi:10.15227/orgsyn.046.0072.
- ↑ Zhang Liang (2013). “N-Heterocyclic carbene (NHC)–copper-catalysed transformations of carbon dioxide”. 《Chemical Science》 4 (9): 3395. doi:10.1039/C3SC51070K.
- ↑ K. Sekine; T. Yamada (2016). “Silver-catalyzed carboxylation”. 《Chem. Soc. Rev.》 45 (16): 4524–4532. doi:10.1039/C5CS00895F.
- ↑ Dhingra A, Portis AR, Daniell H (April 2004). “Enhanced translation of a chloroplast-expressed RbcS gene restores small subunit levels and photosynthesis in nuclear RbcS antisense plants”. 《Proc. Natl. Acad. Sci. U.S.A.》 101 (16): 6315–20. Bibcode:2004PNAS..101.6315D. doi:10.1073/pnas.0400981101. PMC 395966. PMID 15067115.
(Rubisco) is the most prevalent enzyme on this planet, accounting for 30–50% of total soluble protein in the chloroplast;
- ↑ Feller U, Anders I, Mae T (2008). “Rubiscolytics: fate of Rubisco after its enzymatic function in a cell is terminated” (PDF). 《J. Exp. Bot.》 59 (7): 1615–24. doi:10.1093/jxb/erm242. PMID 17975207.
- ↑ Raven, John A. (April 2013). “Rubisco: still the most abundant protein of Earth?”. 《New Phytologist》 198 (1): 1–3. doi:10.1111/nph.12197. 2022년 1월 1일에 원본 문서에서 보존된 문서. 2021년 5월 28일에 확인함.
- ↑ “Biotin – Fact Sheet for Health Professionals”. Office of Dietary Supplements, US National Institutes of Health. 2017년 12월 8일. 2018년 2월 25일에 확인함.
- ↑ OMIM - gamma-glutamyl carboxylase, contributed by McKusick VA, last updated October 2004 [1]
- ↑ Morris DP, Stevens RD, Wright DJ, Stafford DW (1995). “Processive post-translational modification. Vitamin K-dependent carboxylation of a peptide substrate”. 《J. Biol. Chem.》 270 (51): 30491–8. doi:10.1074/jbc.270.51.30491. PMID 8530480.
- ↑ Hauschka PV, Lian JB, Gallop PM (1975). “Direct identification of the calcium-binding amino acid, gamma-carboxyglutamate, in mineralized tissue”. 《Proc. Natl. Acad. Sci. U.S.A.》 72 (10): 3925–9. Bibcode:1975PNAS...72.3925H. doi:10.1073/pnas.72.10.3925. PMC 433109. PMID 1060074.
- ↑ Berg JM, Tymoczko JL, Stryer L. Biochemistry, 5th ed. New York: W. H. Freeman and Company, 2002.
