イオノン
| α-イオノン | |||||
|---|---|---|---|---|---|
| |||||
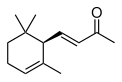
| IUPAC名 | α-イオノン(許容慣用名) 9-アポ-ε-カロテン-9-オン(レチノイド命名法) (E)-4-(2,6,6-トリメチルシクロヘキサ-2-エニル)ブタ-3-エン-2-オン(系統名) | ||||
| 別名 | α-ヨノン | ||||
| 分子式 | C13H20O | ||||
| 分子量 | 192.30 | ||||
| CAS登録番号 | 127-41-3 | ||||
| 形状 | 無色または淡黄色液体 | ||||
| 密度と相 | 0.931 g/cm3, 液体 | ||||
| 沸点 | 131 °C/13 mmHg | ||||
| β-イオノン | |
|---|---|
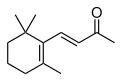 | |
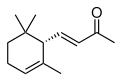
| IUPAC名 | β-イオノン(許容慣用名) 9-アポ-β-カロテン-9-オン(レチノイド命名法) (E)-4-(2,6,6-トリメチルシクロヘキサ-1-エニル)ブタ-3-エン-2-オン(系統名) |
| 別名 | β-ヨノン |
| 分子式 | C13H20O |
| 分子量 | 192.30 |
| CAS登録番号 | 79-77-6 |
| 形状 | 無色または淡黄色液体 |
| 密度と相 | 0.9447 g/cm3, 液体 (20 °C) |
| 融点 | −35 °C |
| 沸点 | 267 °C/1013 hPa |
| 出典 | UNEP (PDF) |
| γ-イオノン | |||||
|---|---|---|---|---|---|
| |||||
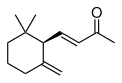
| IUPAC名 | γ-イオノン(許容慣用名) 9-アポ-γ-カロテン-9-オン(レチノイド命名法) (E)-4-(2,2-ジメチル-6-メチレンシクロヘキシル)ブタ-3-エン-2-オン(系統名) | ||||
| 別名 | γ-ヨノン | ||||
| 分子式 | C13H20O | ||||
| 分子量 | 192.30 | ||||
| CAS登録番号 | 79-76-5 | ||||
イオノン(英語: ionone)、別名ヨノン(ドイツ語: Jonon、オランダ語: Jonon)はテルペノイドの一種である。二重結合の位置が違う3種類の異性体があり、それぞれα-イオノン、β-イオノン、γ-イオノンと呼ばれる。スミレの花のようなにおいを持つ、無色または黄色みを帯びた液体である。においは異性体ごとに異なる。
存在
[編集]いずれの異性体もさまざまな植物の精油にみられ、特にベリー、茶、タバコに多い。スミレ精油には約22%のα-イオノンが含まれる。β-イオノンはヘンナなど、γ-イオノンはタマリンドなどに含まれる。α-イオノンには一対の鏡像異性体があるが、天然にはどちらも存在する。
用途
[編集]多く調合香料や食品香料として利用される。含まれる異性体の比率が違うと、そのにおいも異なる。ダマスコンやイソメチルイオノンなど、他の香料を製造する際の原料としても使われる。
β-イオノンはレチノール(ビタミンA)やカロテノイド、および他の香料の合成原料化合物として重要である。2003年における全世界での生産量は4,000から8,000トンと見積もられている[1]。
製造
[編集]植物の精油から得られるが、主に化学合成によって製造される。
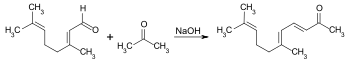
イオノンはプソイドイオノンから合成することができる。シトラールにアセトンを塩基触媒を用いたアルドール反応によって縮合させると、プソイドイオノンが生成する。
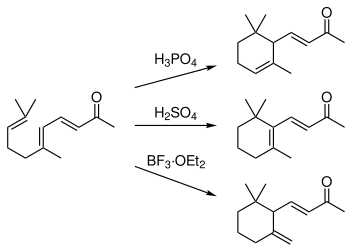
プソイドイオノンに希酸を加えて暖めると環化がおこり、α-イオノンとβ-イオノンの混合物が得られる。反応を行う条件によって、生成するα体とβ体の比率は変わる。リン酸を用いると主としてα-イオノンが、硫酸の場合には主にβ-イオノンが得られる。また、三フッ化ホウ素を使うとγ-イオノンが生成する。
生化学
[編集]ごく少量であっても、ヒトの鼻はイオノンのにおいを感じとることができる。閾値は空気中、α-イオノンでは約3ppb(空気中 3×10−7mg/L)、β-イオノンは0.12ppb、(R)-γ-イオノンは11ppb、(S)-γ-イオノンは0.07ppbとされる[2]。
安全性
[編集]経口での急性毒性は低いとされている。α/β-イオノン混合物 (60:40) のLD50は4590mg/kg(ラット、経口)と報告されている[3]。
イオノンはアレルゲン(感作性物質)となる可能性があり、取り扱いの際には手袋を使うことが推奨されている。
α-イオノンはドイツ水質危害クラス (Wassergefährdungsklasse) でクラス2(危険性あり、endangering)に指定されている。
出典
[編集]- ^ OECD Screening Information DataSet (SIDS). β-Ionone.
- ^ Brenna, E.; Fuganti, Claudio.; Serra, Stefano.; Kraft, P. (2002). "Optically active ionones and derivatives: preparation and olfactory properties." Eur. J. Org. Chem. 967–978. doi:10.1002/1099-0690(200203)2002:6<967::AID-EJOC967>3.0.CO;2-E.
- ^ Jenner, P. M.; Hagan, E. C.; Taylor, J. M.; Cook, E. L.; Fitzhugh, O. G. (1964). "Food flavourings and compounds of related structure I. Acute oral toxicity." Food Cosmet. Toxicol. 2: 327–343. doi:10.1016/S0015-6264(64)80192-9.