Octreotide
| Octreotide | |
|---|---|
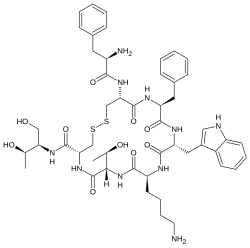 | |
 | |
| Nome IUPAC | |
| (4R,7S,10S,13R,16S,19R)-10-(4-aminobutil)-19- (2R)-2-amino-3-fenil-propanoil]amino]-16- benzil-N-[(2R,3R)-1,3-diidrossibutan-2-il]-7- (1-idrossietil)-13-(1H-indol-3-ilmetil)-6,9,12, 15,18-pentaoxo-1,2-ditia-5,8,11,14,17- pentazacicloicosano-4-carbossamide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C49H66N10O10S2 |
| Massa molecolare (u) | 1019,24 g/mol |
| Numero CAS | |
| Codice ATC | H01 |
| PubChem | 54373 |
| DrugBank | DBDB00104 |
| SMILES | CC(C1C(=O)NC(CSSCC(C(=O)NC(C(=O)NC(C(=O)NC(C(=O)N1)CCCCN)CC2=CNC3=CC=CC=C32)CC4=CC=CC=C4)NC(=O)C(CC5=CC=CC=C5)N)C(=O)NC(CO)C(C)O)O |
| Dati farmacologici | |
| Modalità di somministrazione | sottocutanea, intramuscolare, endovenosa |
| Dati farmacocinetici | |
| Biodisponibilità | 100% |
| Legame proteico | 65% |
| Metabolismo | epatico |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
L'octreotide (nome commerciale Sandostatin[2], Novartis Pharmaceuticals), è un octapeptide analogo della somatostatina che mima l'effetto farmacologico della somatostatina stessa ; farmacocineticamente l'octreotide ha una emivita più lunga della somatostatina grazie alla presenza di D amminoacidi che gli conferiscono una maggiore resistenza alle peptidasi circolanti che si occupano di degradare la somatostatina ; inoltre l'effetto dell'octreotide come inibitore del rilascio di somatotropina, del glucagone e dell'insulina è maggiore in confronto con l'ormone endogeno. L'octreotide è stato sintetizzato per la prima volta nel 1979 dal chimico Wilfried Bauer.
Uso in medicina
[modifica | modifica wikitesto]Tumori
[modifica | modifica wikitesto]L'octreotide è usato per il trattamento di tumori secernenti somatotropina (i.e. acromegalia e gigantismo), tumori dell'ipofisi secernenti tireotropina(TSH: thyroid-stimulatin hormone), diarrea e vampate di calore associate alla sindrome da carcinoide e di diarrea in caso di tumori secernenti peptide intestinale attivo (VIPomi).
Sanguinamento delle varici esofagee
[modifica | modifica wikitesto]Poiché l'octreotide è in grado di ridurre la pressione venosa portale, è usato nel trattamento in fase acuta delle emorragie derivate dalle varici esofagee che si verificano frequentemente in caso di cirrosi epatica. Tuttavia questa pratica ha effetti transitori e al momento non ci sono evidenze che induca ad un aumento della sopravvivenza.[3]
Medicina nucleare
[modifica | modifica wikitesto]L'octreotide marcato con Indio-111 (Octreoscan TM) è utilizzato in medicina nucleare per la localizzazione di tumori neuroendocrini (neuroendocrine tumors, acronimo: NET) o in generale di tumori che esprimono i recettori della somatostatina a livelli elevati[4]. Attraverso la somministrazione di octreotide marcato con un gruppo funzionale tetraazaciclico-macro-legante radioattivo (es: DOTA e DOTA-TOC) ed un opportuno distanziatore (linker) ed una successiva scintigrafia con tomografia a emissione di fotone singolo (SPECT: Single Photon Emission Computed Tomography) è possibile localizzare la sede del tumore primario e delle sue metastasi. È inoltre possibile valutare la progessione (follow-up) della malattia e, in fasi successive, monitorare gli effetti della chemio/radioterapia e la presenza di recidive dopo asportazione chirurgica del tumore.
Più recentemente l'octreotide è stato marcato con altri radionuclidi, quali Carbonio-11[5] o Gallio-68, che hanno permesso l'utilizzo della tomografia a emissione di positroni (PET: positron emisson tomography) e maggiori risoluzione e sensibilità nella diagnosi tumorale.
L'octreotide così marcato viene oggi utilizzato nella terapia peptide/recettore (PRRT: peptide receptor radionuclide therapy) dei tumori neuroendocrini in caso di neoplasie neuroendocrine diffuse o inoperabili. L'octreotide in questo caso viene marcato con isotopi molto più radiotossici dell'indio-111, quali l'ittrio-90 o il lutezio-177g, in grado di distruggere selettivamente le cellule neoplastiche. Nel caso del lutezio-177g, che è contemporaneamente un emettitore gamma e beta, la tecnica viene recentemente specificata come teranostica, perché permette contemporaneamente di visualizzare la biodistribuzione mediante SPECT ed eseguire contemporaneamente la terapia radiometabolica.
Controindicazioni
[modifica | modifica wikitesto]L'octreotide non è stato adeguatamente studiato per il trattamento di bambini, donne in gravidanza o allattamento. Il farmaco è somministrato a queste categorie di pazienti solo se l'analisi rischio-beneficio è positiva.[6][7]
Effetti collaterali
[modifica | modifica wikitesto]Gli effetti collaterali più comuni dovuti all'uso dell'octeotide (più del 10% dei pazienti) sono: mal di testa, ipertiroidismo, cambiamenti nella conduzione cardiaca, reazioni gastrointestinali (crampi, nausea/vomito, diarrea o costipazione), calcoli biliari, diabete mellito, iperglicemia[8] o ipoglicemia, irritazione nelle sedi di iniezione (generalmente transitorie). In più dell'1% dei pazienti trattati con octreotide inoltre si possono manifestare: diminuzione delle pulsazioni cardiache (slow heart rate), reazioni cutanee (e.g. pruritus), iperbilirubinemia, ipertiroidismo, vertigini e dispnea. Raramente si osservano reazioni anafilattiche acute, pancreatiti, epatiti o alopecia.[6][7] Uno studio ha riportato una possibile associazione con l'artrite reumatoide.[9]
In alcuni studi è stata riscontrata alopecia nei pazienti trattati con l'octreotide.[10] In un altro studio del 1998[11] nei ratti trattati con octreotide è stata riscontrata una disfunzione erettile.
Interazioni
[modifica | modifica wikitesto]L'octreotide può ridurre il riassorbimento intestinale delle ciclosporine, influendo così sulla dose di ciclosporine da somministrare[12]. I pazienti che soffrono di diabete mellito, quando trattati con octreotide, possono aver bisogno di una minore dose di insulina o di antidiabetici orali. Inoltre l'octreotide aumenta la biodisponibilità delle bromocriptine, farmaci che vengono utilizzati per il trattamento della malattia di Parkinson e dell'acromegalia.
Effetti farmacologici
[modifica | modifica wikitesto]La struttura simile alla somatostatina permette all'octreotide di svolgere molte delle funzioni dell'ormone endogeno:
- Inibisce la secrezione di diversi ormoni, come gastrina, colecistochinina, glucagone, ormone della crescita, insulina, secretina, polipeptide pancreatico (PP), tireotropina (TSH) e peptide intestinale vasoattivo (VIP);
- Riduce la secrezione di succhi intestinali e pancreatici;
- Riduce la motilità intestinale e inibisce la secrezione della cistifellea;
- Inibisce l'azione di alcuni ormoni dall'ipofisi;
- Provoca vasocostrizione;
- Riduce la pressione portale;
L'octreotide ha dimostrato effetti analgesici, probabilmente dovuti alla sua azione come agonista parziale sui recettori mu-oppioidi .[13][14]
Farmacocinetica
[modifica | modifica wikitesto]In seguito ad una applicazione sottocutanea, l'octreotide è assorbito velocemente e completamente. Le concentrazioni plasmatiche raggiungono il loro massimo dopo 30 minuti. In seguito a somministrazione sottocutanea, l'emivita dell'octreotide in media è 100 minuti (1.7 h); dopo somministrazione endovenosa l'octreotide è eliminato in due fasi, con emivita rispettivamente di 10 e 90 minuti.[6][7]
Ricerca
[modifica | modifica wikitesto]A parte le applicazioni in oncologia e medicina nucleare l'octreotide è stato anche usato come farmaco off-label per il trattamento di altre patologie (e.g. diarrea refrattaria). Viene utilizzato anche in tossicologia del diabete mellito di tipo 2, in particolare in caso di ipoglicemia prolungata e ricorrente dopo trattament con sulfaniluree o in caso di overdose da meglitinidi.
Sebbene con risultati controversi, l'octreotide è anche utilizzato per ridurre la produzione di insulina nella nesidioblastosi infantile.
In numerosi trial clinici l'octreotide è risultato efficace nel trattamento acuto della cefalea a grappolo, dimostrando che la somministrazione sottocutanea è efficace in confronto al placebo.[15]
L'octreotide ha anche applicazioni nel trattamento dell'obesità causata da lesioni ipotalamiche ai centri di fame e sazietà. Questa zona del cervello è responsabile della regolazione dell'assunzione di cibo e del consumo di energia[16]. Il circuito comincia dal nucleo arcuato, una zona dell'ipotalamo che proietta ai nuclei dell'ipotalamo laterale (LH) e ai nuclei dell'ipotalamo ventromediale (VMH), rispettivamente i centri cerebrali della fame e della sazietà.[17][18]
I nuclei VMH possono subire danni in seguito al trattamento prolungato della leucemia linfoblastica acuta (ALL), oppure in seguito a chirurgia o radioterapia per il trattamento di tumori della fossa cranica posteriore.[16]
Con una mancata risposta dei nuclei VMH agli stimoli periferici agli stimoli riguardanti il bilancio energetico, si verifica una diminuzione dell'attività simpatica afferente che induce un malessere generalizzato e riduce il consumo energetico; l'attività del nervo vago aumenta, determinando un aumento della secrezione di insulina e l'adipogenesi.[19] Questa disfunzione dei nuclei VMH, induce un'eccessiva assunzione di calorie, una diminuzione del consumo di energia e ad un continuo e inarrestabile aumento di peso. L'adozione di regimi alimentari che riducano l'assunzione di calorie o terapie farmacologiche con agenti adrenergigi e serotonergici, hanno dimostrato un ridotto successo e comunque solo nel breve periodo. La somministrazion di octreotide in questo contesto riduce l'eccessivo rilascio di insulina, contrastando in ultima analisi l'adipogenesi. In un trial clinico che includeva diciotto pazienti in età pediatrca che presentavano un aumento di peso in seguito a terapia per ALL, tumori cerebreli o altre disfunzioni ipotalamiche, l'octreotide si è rivelato efficace nel ridurre l'índice di masa corporea (BMI) e il rilascio di insulina nei test di tolleranza al glucosio.[16] Rispetto ai placebo, i pazienti trattati con octreotide, presentavano una incremento della attività fisica e della qualità di vita (QoL). In un altro trial placebo-controllo con pazienti adulti obesi che non presentavano lesioni opotalamiche, il gruppo di pazienti trattati con octreotide ha mostrato perdita di peso e riduzione dell'indice di massa corporea (BMI), rispetto ai pazienti che avevano ricevuto placebo. Successive analisi hanno suggerito un effetto più marcato nei pazienti che avevano ricevuto una dose maggiore di octreotide.[20]
L'otreotide è sotto indagine per il trattamento del dolore in pazienti con pancreatite cronica.[21]
Inoltre il farmaco è stato usato nel trattamento di ostruzioni intestinali maligne.[22]
L'octreotide può essere usato insieme alla midodrina per contrastare parzialmente la vasodilatazione periferica che si verifica nella sindrome epatorenale. Con l'aumento della resistenza vascolare sistemica, l'octreotide riduce lo smistamento e migliola la perfusione renale, incrementa la sopravvivenza al definitivo trapianto di fegato.[23] Allo stesso modo, l'octreotide può essere usato per trattare l'ipertensione cronica refrattaria.[24]
Sebbene in alcuni casi clinici[25][26] l'octreotide si è dimostrato efficace nel trattamento del chilotorace[27], tuttavia studi su più vasta scala non hanno confermato i precedenti risultati.
Un altro studio ha suggerito che l'octreotide potrebbe efficace nel trattamoento dell'ipertensione endocranica.[28]
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 14.09.2011
- ^ Landing Page, su sandostatin.com. URL consultato il 18 settembre 2015.
- ^ Gøtzsche PC, Hróbjartsson A (2008). "Somatostatin analogues for acute bleeding oesophageal varices". Cochrane Database Syst Rev (3): CD000193. doi:10.1002/14651858.CD000193.pub3. PMID 18677774.
- ^ (EN) J. C. Reubi, J. C. Schaer e B. Waser, Expression and Localization of Somatostatin Receptor SSTR1, SSTR2, and SSTR3 Messenger RNAs in Primary Human Tumors using in Situ Hybridization, in Cancer Research, vol. 54, n. 13, 1º luglio 1994, pp. 3455-3459. URL consultato il 18 settembre 2015.
- ^ Joshua Chin, Matthew Vesnaver, Vadim Bernard-Gauthier, Erin Saucke-Lacelle, Björn Wängler, Carmen Wängler, Ralf Schirrmacher. Amino Acids: Direct one-step labeling of cysteine residues on peptides with 11C-methyl triflate for the synthesis of PET radiopharmaceuticals. Amino Acids. 2013 Aug 7. PMID 23921782
- ^ a b c Haberfeld, H, ed. (2009). Austria-Codex (in German) (2009/2010 ed.). Vienna: Österreichischer Apothekerverlag. ISBN 3-85200-196-X.
- ^ a b c Dinnendahl, V, Fricke, U, ed. (2010). Arzneistoff-Profile (in German) 8 (23 ed.). Eschborn, Germany: Govi Pharmazeutischer Verlag. ISBN 978-3-7741-9846-3.
- ^ Hovind P, Simonsen L, Bülow J (March 2010). "Decreased leg glucose uptake during exercise contributes to the hyperglycaemic effect of octreotide". Clin Physiol Funct Imaging 30 (2): 141–5. doi:10.1111/j.1475-097X.2009.00917.x. PMID 20132129.
- ^ joplink.net, https://web.archive.org/web/20170809095808/http://www.joplink.net/prev/201107/201107_07.pdf (archiviato dall'url originale il 9 agosto 2017).
- ^ van der Lely AJ, de Herder WW, Lamberts SW (November 1997). "A risk-benefit assessment of octreotide in the treatment of acromegaly". Drug Saf 17 (5): 317–24. doi:10.2165/00002018-199717050-00004. PMID 9391775.
- ^ Kapicioglu S, Mollamehmetoglu M, Kutlu N, Can G, Ozgur GK (January 1998). "Inhibition of penile erection in rats by a long-acting somatostatin analogue, octreotide (SMS 201-995)". Br J Urol 81 (1): 142–5.
- ^ Klopp, T, ed. (2010). Arzneimittel-Interaktionen (in German) (2010/2011 ed.). Arbeitsgemeinschaft für Pharmazeutische Information. ISBN 978-3-85200-207-1.
- ^ R. Maurer, B. H. Gaehwiler e H. H. Buescher, Opiate antagonistic properties of an octapeptide somatostatin analog, in Proceedings of the National Academy of Sciences of the United States of America, vol. 79, n. 15, 1º agosto 1982, pp. 4815-4817. URL consultato il 18 settembre 2015.
- ^ M. P. Allen, J. F. Blake e D. K. Bryce, Design, synthesis and biological evaluation of 3-amino-3-phenylpropionamide derivatives as novel mu opioid receptor ligands, in Bioorganic & Medicinal Chemistry Letters, vol. 10, n. 6, 20 marzo 2000, pp. 523-526. URL consultato il 18 settembre 2015.
- ^ Manjit S. Matharu, Miles J. Levy e Karim Meeran, Subcutaneous octreotide in cluster headache: randomized placebo-controlled double-blind crossover study, in Annals of Neurology, vol. 56, n. 4, 1º ottobre 2004, pp. 488-494, DOI:10.1002/ana.20210. URL consultato il 18 settembre 2015.
- ^ a b c Robert H. Lustig, Pamela S. Hinds e Karen Ringwald-Smith, Octreotide Therapy of Pediatric Hypothalamic Obesity: A Double-Blind, Placebo-Controlled Trial [collegamento interrotto], in The Journal of Clinical Endocrinology & Metabolism, vol. 88, n. 6, 1º giugno 2003, pp. 2586-2592, DOI:10.1210/jc.2002-030003. URL consultato il 18 settembre 2015.
- ^ Jeffrey S Flier, Obesity Wars: Molecular Progress Confronts an Expanding Epidemic, in Cell, vol. 116, n. 2, 23 gennaio 2004, pp. 337-350, DOI:10.1016/S0092-8674(03)01081-X. URL consultato il 18 settembre 2015.
- ^ Boulpaep, Emile L.; Boron, Walter F. (2003). Medical physiologya: A cellular and molecular approach. Philadelphia: Saunders. p. 1227. ISBN 0-7216-3256-4.
- ^ Robert H. Lustig, Hypothalamic Obesity after Craniopharyngioma: Mechanisms, Diagnosis, and Treatment, in Frontiers in Endocrinology, vol. 2, 3 novembre 2011, DOI:10.3389/fendo.2011.00060. URL consultato il 18 settembre 2015.
- ^ (EN) R. H. Lustig, F. Greenway e P. Velasquez-Mieyer, A multicenter, randomized, double-blind, placebo-controlled, dose-finding trial of a long-acting formulation of octreotide in promoting weight loss in obese adults with insulin hypersecretion, in International Journal of Obesity, vol. 30, n. 2, 13 settembre 2005, pp. 331-341, DOI:10.1038/sj.ijo.0803074. URL consultato il 18 settembre 2015.
- ^ https://www.karger.com/Article/Abstract/51477, su karger.com. URL consultato il 18 settembre 2015.
- ^ (EN) Yasuo Shima, Atshushi Ohtsu e Kuniaki Shirao, Clinical Efficacy and Safety of Octreotide (SMS201-995) in Terminally Ill Japanese Cancer Patients with Malignant Bowel Obstruction, in Japanese Journal of Clinical Oncology, vol. 38, n. 5, 1º maggio 2008, pp. 354-359, DOI:10.1093/jjco/hyn035. URL consultato il 18 settembre 2015.
- ^ Skagen C, Einstein M, Lucey MR, Said A (Feb 2009). "Combination Treatment With Octreotide, Midodrine, and Albumin Improves Survival in Patients With Type 1 and Type 2 Hepatorenal Syndrome.". J Clin Gastroenterol. 43 (7): 680–5.
- ^ Low Blood Pressure. Hypotension, Low Pressure Symptoms | Patient, su Patient. URL consultato il 18 settembre 2015.
- ^ Dalokay Kilic, Ekber Sahin e Oner Gulcan, Octreotide for Treating Chylothorax after Cardiac Surgery, in Texas Heart Institute Journal, vol. 32, n. 3, 1º gennaio 2005, pp. 437-439. URL consultato il 18 settembre 2015.
- ^ (EN) Sylvia LY Siu e David SY Lam, Spontaneous neonatal chylothorax treated with octreotide, in Journal of Paediatrics and Child Health, vol. 42, n. 1-2, 1º gennaio 2006, pp. 65-67, DOI:10.1111/j.1440-1754.2006.00788.x. URL consultato il 18 settembre 2015.
- ^ Emily H. Chan, Jennifer L. Russell e William G. Williams, Postoperative Chylothorax After Cardiothoracic Surgery in Children, in The Annals of Thoracic Surgery, vol. 80, n. 5, 1º novembre 2005, pp. 1864-1870, DOI:10.1016/j.athoracsur.2005.04.048. URL consultato il 18 settembre 2015.
- ^ G. N. Panagopoulos, S. N. Deftereos e G. A. Tagaris, Octreotide: a therapeutic option for idiopathic intracranial hypertension, in Neurology, Neurophysiology, and Neuroscience, 1º gennaio 2007, p. 1. URL consultato il 18 settembre 2015.
