Lettiera

La lettiera, dal punto di vista ecologico e pedologico, è la mistura di sostanze organiche morte situate sulla superficie del suolo, come rami, foglie e animali. Le sostanze sottostanti in via di decomposizione raggiungono prima o poi l'aspetto umificato.
Essa è tra l'altro, un'importante riserva di carbonio[1][2].
Svantaggi
[modifica | modifica wikitesto]L'eccessivo accumulo delle sostanze organiche morte sul terreno può provocare asfissia rendendolo inerte, mentre i sali minerali volatilizzano o si depositano nelle falde freatiche per azione di pioggia.
Caratteristiche e variabilità
[modifica | modifica wikitesto]La lettiera è caratterizzata da detriti vegetali freschi, non decomposti e facilmente riconoscibili (per specie e tipo). Può trattarsi di qualsiasi cosa, dalle foglie, ai coni, agli aghi, ai rametti, alla corteccia, ai semi/noci, ai tronchi o agli organi riproduttivi (ad esempio gli stami delle piante da fiore). Gli elementi con un diametro superiore a 2 cm sono definiti "lettiera grossolana", mentre quelli più piccoli sono definiti "lettiera fine". Il tipo di lettiera è influenzato più direttamente dal tipo di ecosistema. Ad esempio, i tessuti fogliari rappresentano circa il 70% della lettiera nelle foreste, ma la lettiera legnosa tende ad aumentare con l'età della foresta[3]. Nelle praterie, c'è pochissimo tessuto perenne fuori terra, quindi la lettiera annuale è molto bassa e quasi uguale alla produzione primaria netta[4].
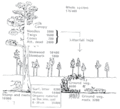
Nella pedologia, la lettiera del suolo è classificata in tre strati, che si formano sulla superficie dell'orizzonte O. Questi sono gli strati L, F e H[5]:
- L – orizzonte organico caratterizzato da materiale vegetale relativamente non decomposto (descritto sopra).
- F – orizzonte organico che si trova sotto L caratterizzato dall’accumulo di materia organica parzialmente decomposta.
- H – orizzonte organico al di sotto di F caratterizzato da accumulo di materia organica completamente decomposta per lo più indiscernibile
Lo strato di lettiera è piuttosto variabile nel suo spessore, tasso di decomposizione e contenuto di nutrienti ed è influenzato in parte dalla stagionalità, dalle specie vegetali, dal clima, dalla fertilità del suolo, dall'altitudine e dalla latitudine[6]. La variabilità più estrema della lettiera è vista come una funzione della stagionalità; ogni singola specie di pianta ha perdite stagionali di alcune parti del suo corpo, che possono essere determinate dalla raccolta e dalla classificazione della lettiera vegetale durante l'anno e a loro volta influenzano lo spessore dello strato di lettiera. Negli ambienti tropicali, la maggiore quantità di detriti cade nell'ultima parte delle stagioni secche e all'inizio della stagione umida[7]. Come risultato di questa variabilità dovuta alle stagioni, anche il tasso di decomposizione per qualsiasi data area sarà variabile.
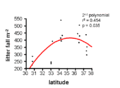
Anche la latitudine ha un forte effetto sui tassi e sullo spessore della lettiera. In particolare, la lettiera diminuisce con l'aumentare della latitudine. Nelle foreste pluviali tropicali, c'è uno strato sottile di lettiera a causa della rapida decomposizione[8], mentre nelle foreste boreali, il tasso di decomposizione è più lento e porta all'accumulo di uno spesso strato di lettiera, noto anche come humus[4]. La produzione primaria netta funziona inversamente a questa tendenza, suggerendo che l'accumulo di materia organica è principalmente il risultato del tasso di decomposizione.
I detriti superficiali facilitano la cattura e l'infiltrazione dell'acqua piovana negli strati inferiori del terreno. I detriti superficiali proteggono anche il terreno dall'eccessiva essiccazione e dal riscaldamento[9]. La lettiera del terreno protegge gli aggregati del terreno dall'impatto delle gocce di pioggia, impedendo il rilascio di particelle di argilla e limo che ostruiscono i pori del terreno[10]. Il rilascio di particelle di argilla e limo riduce la capacità del terreno di assorbire acqua e aumenta il flusso trasversale superficiale, accelerando l'erosione del terreno. Inoltre, la lettiera del terreno riduce l'erosione eolica impedendo al terreno di perdere umidità e fornendo una copertura che impedisce il trasporto del terreno.
L'accumulo di materia organica aiuta anche a proteggere i terreni dai danni degli incendi boschivi. La lettiera del terreno può essere completamente rimossa a seconda dell'intensità e della gravità degli incendi boschivi e della stagione[11]. Le regioni con incendi boschivi ad alta frequenza hanno una densità di vegetazione ridotta e un accumulo ridotto di lettiera del terreno. Il clima influenza anche la profondità della lettiera vegetale. I climi tropicali e subtropicali tipicamente umidi hanno strati e orizzonti di materia organica ridotti a causa della decomposizione durante tutto l'anno e dell'elevata densità e crescita della vegetazione. Nei climi temperati e freddi, la lettiera tende ad accumularsi e decomporsi più lentamente a causa di una stagione di crescita più breve.
Produzione primaria netta
[modifica | modifica wikitesto]La produzione primaria netta e la caduta di lettiera sono intimamente connesse. A causa della loro interconnessione, i modelli globali di caduta di lettiera sono simili ai modelli globali di produttività primaria netta[4]. La lettiera vegetale, che può essere composta da foglie cadute, ramoscelli, semi, fiori e altri detriti legnosi, costituisce una grande porzione della produzione primaria netta fuori terra di tutti gli ecosistemi terrestri. I funghi svolgono un ruolo importante nel riciclo dei nutrienti dalla lettiera vegetale all'ecosistema[12].
Habitat e cibo
[modifica | modifica wikitesto]La lettiera fornisce un habitat per una varietà di organismi.
Piante
[modifica | modifica wikitesto]Alcune piante sono particolarmente adatte a germinare e prosperare negli strati di lettiera[13]. Ad esempio, i germogli di campanula (Hyacinthoides non-scripta) perforano lo strato per emergere in primavera. Alcune piante con rizomi, come l'acetosella comune (Oxalis acetosella) si trovano bene in questo habitat[8].
Detritivori e altri decompositori
[modifica | modifica wikitesto]Molti organismi che vivono sul suolo della foresta sono decompositori, come i funghi. Gli organismi la cui dieta consiste in detriti vegetali, come i lombrichi, sono definiti detritivori. La comunità di decompositori nello strato di lettiera include anche batteri, amebe, nematodi, rotiferi, tardigradi, collemboli, vermi, larve di insetti, molluschi, acari oribatidi, porcellini di terra e millepiedi[8]. Anche alcune specie di microcrostacei, in particolare i copepodi (ad esempio Bryocyclops spp., Graeteriella spp., Olmeccyclops hondo, Moraria spp., Bryocamptus spp., Atheyella spp.)[14] vivono in habitat di lettiera di foglie umide e svolgono un ruolo importante come predatori e decompositori[15].
Il consumo della lettiera da parte dei decompositori determina la scomposizione di semplici composti di carbonio in anidride carbonica (CO2) e acqua (H2O), e rilascia ioni inorganici (come azoto e fosforo) nel terreno, dove le piante circostanti possono quindi riassorbire i nutrienti che sono stati rilasciati come lettiera. In questo modo, la lettiera diventa una parte importante del ciclo dei nutrienti che sostiene gli ambienti forestali.
Quando la lettiera si decompone, i nutrienti vengono rilasciati nell'ambiente. La parte della lettiera che non è facilmente decomponibile è nota come humus. La lettiera aiuta a trattenere l'umidità del suolo raffreddando la superficie del terreno e trattenendo l'umidità nella materia organica in decomposizione. La flora e la fauna che lavorano per decomporre la lettiera del suolo aiutano anche la respirazione del suolo. Uno strato di lettiera di biomassa in decomposizione fornisce una fonte di energia continua per macro e microrganismi[9][16].
Animali più grandi
[modifica | modifica wikitesto]Numerosi rettili, anfibi, uccelli e persino alcuni mammiferi dipendono dalla lettiera per ripararsi e procurarsi il foraggio. Anfibi come salamandre e Apodi vivono nel microclima umido sotto le foglie cadute per parte o per tutto il loro ciclo vitale. Ciò li rende difficili da osservare. Una troupe cinematografica della BBC ha ripreso per la prima volta un filmato di una femmina di cecilia con i suoi piccoli in un documentario trasmesso nel 2008[17]. Alcune specie di uccelli, come ad esempio il fornaio dell'America settentrionale orientale, necessitano di lettiera di foglie sia per il foraggiamento che per il materiale per i nidi[18]. A volte la lettiera fornisce energia anche a mammiferi molto più grandi, come nelle foreste boreali dove la lettiera di licheni è uno dei principali costituenti della dieta invernale dei cervi e degli alci[19].
Ciclo dei nutrienti
[modifica | modifica wikitesto]Durante la senescenza fogliare, una parte dei nutrienti della pianta viene riassorbita dalle foglie. Le concentrazioni di nutrienti nella lettiera differiscono dalle concentrazioni di nutrienti nel fogliame maturo per il riassorbimento dei costituenti durante la senescenza fogliare[4]. Le piante che crescono in aree con bassa disponibilità di nutrienti tendono a produrre lettiera con basse concentrazioni di nutrienti, poiché una quota maggiore dei nutrienti disponibili viene riassorbita. Dopo la senescenza, le foglie arricchite di nutrienti diventano lettiera e si depositano sul terreno sottostante.
La lettiera è la via dominante per il ritorno dei nutrienti al suolo, in particolare per azoto (N) e fosforo (P). L'accumulo di questi nutrienti nello strato superiore del suolo è noto come immobilizzazione del suolo. Una volta che la lettiera si è depositata, la decomposizione dello strato di lettiera, realizzata attraverso la lisciviazione dei nutrienti da parte delle precipitazioni e delle precipitazioni e dagli sforzi dei detritivori, rilascia i prodotti di degradazione nel suolo sottostante e quindi contribuisce alla capacità di scambio cationico del suolo. Ciò è particolarmente vero per i suoli tropicali altamente alterati[20]. Il tasso di decomposizione è legato al tipo di lettiera presente[13].
La lisciviazione è il processo mediante il quale cationi come ferro (Fe) e alluminio (Al), così come la materia organica, vengono rimossi dalla lettiera e trasportati verso il basso nel terreno sottostante. Questo processo è noto come podzolizzazione ed è particolarmente intenso nelle foreste boreali e temperate fredde che sono costituite principalmente da pini conifere la cui lettiera è ricca di composti fenolici e acido fulvico[4].
Attraverso il processo di decomposizione biologica da parte di microfauna, batteri e funghi, vengono rilasciati CO2 e H2O, elementi nutritivi e una sostanza organica resistente alla decomposizione chiamata humus. L'humus compone la maggior parte della materia organica nel profilo inferiore del suolo[4].
Il declino dei rapporti nutrizionali è anche una funzione della decomposizione della lettiera (vale a dire che quando la lettiera si decompone, più nutrienti entrano nel terreno sottostante e la lettiera avrà un rapporto nutrizionale più basso). La lettiera contenente alte concentrazioni di nutrienti si decomporrà più rapidamente e andrà in asintoto man mano che quei nutrienti diminuiscono[21]. Sapendo questo, gli ecologi sono stati in grado di utilizzare le concentrazioni di nutrienti misurate dal telerilevamento come indice di un potenziale tasso di decomposizione per una data area[21]. A livello globale, i dati provenienti da vari ecosistemi forestali mostrano una relazione inversa tra il declino dei rapporti nutrizionali e l'apparente disponibilità nutrizionale della foresta[4].
Una volta che i nutrienti sono rientrati nel terreno, le piante possono riassorbirli attraverso le radici. Pertanto, il riassorbimento dei nutrienti durante la senescenza rappresenta un'opportunità per il futuro utilizzo della produzione primaria netta di una pianta. Una relazione tra le riserve di nutrienti può anche essere definita come:
- stoccaggio annuale di nutrienti nei tessuti vegetali + sostituzione delle perdite dovute alla lettiera e alla lisciviazione = quantità di assorbimento in un ecosistema
Rifiuti non terrestri
[modifica | modifica wikitesto]La caduta di rifiuti non terrestri segue un percorso molto diverso. I rifiuti vengono prodotti sia nell'entroterra dalle piante terrestri e spostati verso la costa dai processi fluviali, sia dagli ecosistemi di mangrovie[22]. Dalla costa, Robertson & Daniel 1989 hanno scoperto che vengono poi rimossi dalla marea, dai granchi e dai microbi. Hanno anche notato che quale di questi tre è più significativo dipende dal regime di marea. Nordhaus e altri nel 2011 hanno scoperto che i granchi cercano foglie durante la bassa marea e se la loro detritivoria è la via di smaltimento predominante, possono prendere l'80% del materiale fogliare. Bakkar e altri nel 2017 hanno studiato il contributo chimico della defecazione dei granchi risultante. Hanno scoperto che i granchi passano una notevole quantità di lignina non degradata sia ai sedimenti che alla composizione dell'acqua. Hanno anche scoperto che l'esatto contributo carbonioso di ciascuna specie vegetale può essere tracciato dalla pianta, attraverso il granchio, alla sua disposizione nei sedimenti o nell'acqua in questo modo. I granchi sono solitamente l'unica macrofauna significativa in questo processo, tuttavia Raw e altri nel 2017 hanno scoperto che la Terebralia palustris compete con i granchi in modo insolitamente vigoroso nel sud-est asiatico[23].
Raccolta e analisi
[modifica | modifica wikitesto]
Gli obiettivi principali del campionamento e dell'analisi della lettiera sono quantificare la produzione della lettiera e la sua composizione chimica nel tempo al fine di valutare la variazione delle quantità di lettiera e quindi il suo ruolo nel ciclo dei nutrienti attraverso un gradiente ambientale di clima (umidità e temperatura) e condizioni del suolo[24].
Gli ecologi adottano un approccio semplice alla raccolta dei rifiuti, la maggior parte dei quali si concentra su un unico pezzo di equipaggiamento, noto come "sacco per i rifiuti" (litterbag). Esso è semplicemente un qualsiasi tipo di contenitore che può essere disposto in una determinata area per un periodo di tempo specificato per raccogliere i rifiuti vegetali che cadono dalla canopia soprastante.
I sacchi per i rifiuti sono generalmente posizionati in posizioni casuali all'interno di una determinata area e contrassegnati con GPS o coordinate locali, quindi monitorati in un intervallo di tempo specifico. Una volta raccolti i campioni, vengono solitamente classificati in base a tipo, dimensione e specie (se possibile) e registrati su un foglio di calcolo[25]. Quando si misura la caduta di rifiuti in massa per un'area, gli ecologi peseranno il contenuto secco del sacco per i rifiuti. Con questo metodo il flusso di caduta di rifiuti può essere definito come:
- lettiera caduta (kg m−2 yr−1) = massa totale della lettiera (kg)/area del sacco della lettiera (m2)[26]
Il sacco per i rifiuti può anche essere utilizzato per studiare la decomposizione dello strato di lettiera. Confinando la lettiera fresca nei sacchetti a rete e posizionandoli sul terreno, un ecologo può monitorare e raccogliere le misurazioni del decadimento di quella lettiera[8]. Un modello di decadimento esponenziale è stato prodotto da questo tipo di esperimento: dove è la lettiera iniziale e è una frazione costante della massa detritica[4].
In questi esperimenti viene utilizzato anche l'approccio del bilancio di massa, che suggerisce che la decomposizione per un dato lasso di tempo dovrebbe essere uguale all'immissione di rifiuti nello stesso lasso di tempo.
- lettiera = k(massa detritica)[4]
Per studiare i vari gruppi della fauna edafica è necessario utilizzare maglie di diverse dimensioni nei sacchi per la lettiera[27].
Problemi
[modifica | modifica wikitesto]Cambiamento dovuto ai lombrichi invasivi
[modifica | modifica wikitesto]In alcune regioni del Nord America ghiacciato, i lombrichi sono stati introdotti dove non sono nativi. I lombrichi non nativi hanno portato a cambiamenti ambientali accelerando il tasso di decomposizione della lettiera. Questi cambiamenti sono in fase di studio, ma potrebbero avere impatti negativi su alcuni abitanti come le salamandre[28].
Rastrellamento dei rifiuti forestali
[modifica | modifica wikitesto]L'accumulo di lettiera di foglie dipende da fattori come il vento, il tasso di decomposizione e la composizione delle specie della foresta. La quantità, la profondità e l'umidità della lettiera di foglie variano nei diversi habitat. La lettiera di foglie che si trova nelle foreste primarie è più abbondante, più profonda e trattiene più umidità rispetto alle foreste secondarie. Questa condizione consente anche una quantità di lettiera di foglie più stabile durante tutto l'anno[29]. Questo sottile e delicato strato di materiale organico può essere facilmente influenzato dall'uomo. Ad esempio, la rastrellatura della lettiera forestale come sostituzione della paglia nell'allevamento è una vecchia pratica non forestale nella gestione forestale che è stata diffusa in Europa dal diciassettesimo secolo[30][31]. Nel 1853, si stimava che 50 Tg di lettiera secca all'anno venissero rastrellate nelle foreste europee, quando la pratica raggiunse il suo apice[32]. Questo disturbo umano, se non combinato con altri fattori di degradazione, potrebbe promuovere la podzolizzazione; se gestita correttamente (ad esempio, seppellendo la lettiera rimossa dopo il suo utilizzo nell’allevamento animale), anche la ripetuta rimozione della biomassa forestale può non avere effetti negativi sulla pedogenesi[33].
Galleria d'immagini
[modifica | modifica wikitesto]-
Lettiera vegetale, principalmente cicuta occidentale, Tsuga heterophylla, nella foresta nazionale di Mount Baker-Snoqualmie, Washington, Stati Uniti.
-
Caduta di rifiuti nella rete paludosa nordamericana di Baldcypress, dall'Illinois alla Louisiana, 2003.
-
Acetosella comune (Oxalis acetosella) nell'oblast' di Ivanovo, Russia
-
Funghi nel suolo della foresta di Marselisborg in Danimarca
-
Uno scinco, Eutropis multifasciata, nella lettiera di foglie a Sabah, Malesia
-
Un bilancio per la materia organica in una monocoltura di pino silvestre maturo (120 anni) (sito SWECON). Basato su dati di Andersson e altri (1980). Le unità sono in kg di materia organica per ettaro.
Note
[modifica | modifica wikitesto]- ^ From plant litter to soil organic matter: a game to understand carbon dynamics, su esajournals.onlinelibrary.wiley.com.
- ^ (EN) Matthew E. Craig, Kevin M. Geyer e Katilyn V. Beidler, Fast-decaying plant litter enhances soil carbon in temperate forests but not through microbial physiological traits, in Nature Communications, vol. 13, n. 1, 9 marzo 2022, pp. 1229, DOI:10.1038/s41467-022-28715-9. URL consultato il 1º ottobre 2024.
- ^ Predicting the Amount of Litterfall in Forests of the World, su academic.oup.com.
- ^ a b c d e f g h i Schlesinger, William H. Biogeochemistry: An Analysis of Global Change. 2nd Edition. Academic Press. 108, 135, 152–158, 180–183, 191–194. (1997).
- ^ (EN) Katherine Miller, Research Guides: Soil Science: Getting Started, su guides.library.ubc.ca. URL consultato il 1º ottobre 2024.
- ^ Raúl Ochoa-Hueso, Manuel Delgado-Baquerizo e Paul Tuan An King, Ecosystem type and resource quality are more important than global change drivers in regulating early stages of litter decomposition, in Soil Biology and Biochemistry, vol. 129, 1º febbraio 2019, pp. 144–152, DOI:10.1016/j.soilbio.2018.11.009. URL consultato il 1º ottobre 2024.
- ^ A. V. Spain, Litterfall and the Standing Crop of Litter in Three Tropical Australian Rainforests, in Journal of Ecology, vol. 72, n. 3, 1984, pp. 947–961, DOI:10.2307/2259543. URL consultato il 1º ottobre 2024.
- ^ a b c d Packham, J.R.; Harding, D.J.L.; Hilton, G.M.; Stuttard, R.A. (1992). Functional Ecology of Woodlands and Forests. London: Chapman & Hall. pp. 133–134, 246–247, 265. ISBN 0-412-43950-6.
- ^ a b Jing Wang, Mengli Zhao e Walter D. Willms, Can plant litter affect net primary production of a typical steppe in Inner Mongolia?, in Journal of Vegetation Science, vol. 22, n. 2, 2011-04, pp. 367–376, DOI:10.1111/j.1654-1103.2011.01257.x. URL consultato il 1º ottobre 2024.
- ^ (EN) D S Chanasyk, I R Whitson e E Mapfumo, The impacts of forest harvest and wildfire on soils and hydrology in temperate forests: A baseline to develop hypotheses for the Boreal Plain, in Journal of Environmental Engineering and Science, vol. 2, Supplement 1, 1º giugno 2003, pp. S51–S62, DOI:10.1139/s03-034. URL consultato il 1º ottobre 2024.
- ^ Effects of Wildfire on Soils and Watershed Processes, su academic.oup.com.
- ^ Life in leaf litter: Fungal community succession during decomposition (PDF), su mycosphere.org.
- ^ a b (EN) Shaojun Xiong e Christer Nilsson, The effects of plant litter on vegetation: a meta‐analysis, in Journal of Ecology, vol. 87, n. 6, 1999-12, pp. 984–994, DOI:10.1046/j.1365-2745.1999.00414.x. URL consultato il 1º ottobre 2024.
- ^ (EN) Frank Fiers e Merlijn Jocque, Leaf litter copepods from a cloud forest mountain top in Honduras (Copepoda: Cyclopidae, Canthocamptidae), in Zootaxa, vol. 3630, n. 2, 20 marzo 2013, pp. 270–290, DOI:10.11646/zootaxa.3630.2.4. URL consultato il 1º ottobre 2024.
- ^ Cryptozoic copepods from Belgium: Diversity and biogeographic implications, su researchgate.net.
- ^ The importance of soil organic matter, su www.fao.org. URL consultato il 1º ottobre 2024.
- ^ Writer David Attenborough, Director Scott Alexander, Producer Hilary Jeffkins (2008-02-11). "Land Invaders". Life in Cold Blood. BBC. BBC One.
- ^ Dunn, Jon; Garrett, Kimball (1997). Warblers. New York: Peterson Field Guides. p. 451. ISBN 0-395-78321-6.
- ^ [1081:LLCBWD2.0.CO;2.short LICHEN LITTERFALL CONSUMPTION BY WINTERING DEER AND ELK IN WESTERN MONTANA], su bioone.org.
- ^ (EN) J. Chave, D. Navarrete e S. Almeida, Regional and seasonal patterns of litterfall in tropical South America, in Biogeosciences, vol. 7, n. 1, 5 gennaio 2010, pp. 43–55, DOI:10.5194/bg-7-43-2010. URL consultato il 1º ottobre 2024.
- ^ a b Interactions of biogeochemical cycles (PDF), su nature.com.
- ^ (EN) Aaron B. Stoler e Rick A. Relyea, Reviewing the role of plant litter inputs to forested wetland ecosystems: leafing through the literature, in Ecological Monographs, vol. 90, n. 2, 2020-05, DOI:10.1002/ecm.1400. URL consultato il 1º ottobre 2024.
- ^ Simon M. Cragg, Daniel A. Friess e Lucy G. Gillis, Vascular plants are globally significant contributors to marine carbon fluxes and sinks, in Annual Review of Marine Science, vol. 12, n. 1, 3 gennaio 2020, pp. 16.1–16.29, DOI:10.1146/annurev-marine-010318-095333. URL consultato il 1º ottobre 2024.
- ^ Simmons, Jeffrey A. “Measuring Litterfall Flux.” West Virginia Wesleyan College (2003).
- ^ Estrella, Stephanie. “Standard Operating Procedures for Litterfall Collection, Processing, and Analysis: Version 2.0.” Washington State Department of Ecology. (2008).
- ^ Sampling and Analysis of Litterfall, su researchgate.net.
- ^ Ricardo A. Castro-Huerta, Liliana B. Falco e Rosana V. Sandler, Differential contribution of soil biota groups to plant litter decomposition as mediated by soil use, in PeerJ, vol. 3, 5 marzo 2015, pp. e826, DOI:10.7717/peerj.826. URL consultato il 1º ottobre 2024.
- ^ (EN) John C. Maerz, Victoria A. Nuzzo e Bernd Blossey, Declines in Woodland Salamander Abundance Associated with Non‐Native Earthworm and Plant Invasions, in Conservation Biology, vol. 23, n. 4, 2009-08, pp. 975–981, DOI:10.1111/j.1523-1739.2009.01167.x. URL consultato il 1º ottobre 2024.
- ^ (ES) Zaidett Barrientos, Dynamics of leaf litter humidity, depth and quantity: two restoration strategies failed to mimic ground microhabitat conditions of a low montane and premontane forest in Costa Rica., in Revista de Biología Tropical, vol. 60, n. 3, 1º settembre 2012, pp. 1041–1053, DOI:10.15517/rbt.v60i3.1756. URL consultato il 1º ottobre 2024.
- ^ (EN) Matthias Bürgi e Urs Gimmi, Three objectives of historical ecology: the case of litter collecting in Central European forests, in Landscape Ecology, 2007, pp. 77–87, DOI:10.1007/s10980-007-9128-0. URL consultato il 1º ottobre 2024.
- ^ (EN) Urs Gimmi, Benjamin Poulter e Annett Wolf, Soil carbon pools in Swiss forests show legacy effects from historic forest litter raking, in Landscape Ecology, vol. 28, n. 5, 1º maggio 2013, pp. 835–846, DOI:10.1007/s10980-012-9778-4. URL consultato il 1º ottobre 2024.
- ^ (EN) M. J. McGrath, S. Luyssaert e P. Meyfroidt, Reconstructing European forest management from 1600 to 2010, in Biogeosciences, vol. 12, n. 14, 23 luglio 2015, pp. 4291–4316, DOI:10.5194/bg-12-4291-2015. URL consultato il 1º ottobre 2024.
- ^ Riccardo Scalenghe, Anna Paola Minoja e Stephan Zimmermann, Consequence of litter removal on pedogenesis: A case study in Bachs and Irchel (Switzerland), 1º giugno 2016, DOI:10.1016/j.geoderma.2016.02.024. URL consultato il 1º ottobre 2024.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su lettiera
Wikimedia Commons contiene immagini o altri file su lettiera
| Controllo di autorità | Thesaurus BNCF 55749 · LCCN (EN) sh99002893 · J9U (EN, HE) 987007530362805171 |
|---|