Ամինոգլիկոզիդներ

Ամինոգլիկոզիդներ, բժշկական և բակտերիոլոգիական կատեգոր��աներին պատկանող գրամ բացասական բակտերիաների նկատմամբ հակամանրէային ակտիվություն ունեցող դասական դեղեր են, որոնք ընկճում են սպիտակուցի սինթեզը մանրէի բջջում և իրենց մոլեկուլի կառուցվածքում պարունակում են ամինո-տեղակալված գլիկոզիդ (շաքար)[1][2]։ Այս տերմինն ընդհանուր առմամբ կարող է վերաբերվել նաև ցանկացած այլ օրգանական մոլեկուլին, որը պարունակում է ամինաշաքարային խումբ։ Ամինոգլիկոզիդների հակաբիոտիկ ակտիվությունը դրսևորվում է բակտերիասպան ազդեցությամբ գրամ բացասական աերոբ և որոշ անաերոբ բացիլների նկատմամբ, որոնց մոտ դեռևս չի զարգացել կայունություն դեղի նկատմամբ։ Հիմնականում ակտիվ չեն գրամ դրական և անաերոբ գրամ բացասական բակտերիաների նկատմամբ[3]։
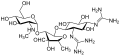
Ստրեպտոմիցինը ամինոգլիկոզիդների շարքի առաջին ընտրության դեղն է։ Այն ստացվել է Streptomyces griseus մանրէից և առաջին ժամանակակից միջոցն է, որն օգտագործվեց տուբերկուլոզի դեմ։ Ստրեպտոմիցինի մոլեկուլում բացակայում է 2-դեօքսիստրեպտամինային խումբը (պատկերված է ստորինաջ կողմում), որն առկա է այս խմբի այլ դեղերի մեծամասնության մոտ։ Ամինոգլիկոզիդների շարքին պատկանող, դեօքսիստրեպտամինային խումբ պարունակող դեղերից են կանամիցինը, տոբրամիցինը, գենտամիցինը և նեոմիցինը (տե՛ս ներքևում)։
Անվանակարգ
[խմբագրել | խմբագրել կոդը]
Այն ամինոգլիկոզիդները, որոնք ստացվել են Streptomyces genus մանրէից, իրենց անվանման մեջ ունեն -mycin վերջածանցը, մինչդեռ Micromonospora մանրէից ստացվածները՝ -micin[4][5]։ Այնուամենայնիվ այս անվանակարգը ամինոգլիկոզիդների դասակարգման համար այդքան էլ կարևոր չէ և այս վերջավորությունների տարբերությունը չի ազդում ընդհանուր ազդեցության մեխանիզմի վրա (oրինակ՝ վանկոմիցինը (vancomycin), որը գլիկոպեպտիդային հակաբիոտիկ է կամ էրիթրոմիցինը (erythromycin)՝ մակրոլիդների շարքի հակաբիոտիկ, երկուսն էլ ստացված Saccharopolyspora erythraea մանրէից, ինչպես նաև նրանց սինթետիկ ածանցյալները՝ կլարիթրոմիցինը (clarithromycin) և ազիթրոմիցինը (azithromycin), բոլորը ունեն նույն վերջածանցը, բայց զգալիորեն տարբերվող ազդեցության մեխանիզմ[6][7]):
Ստորև բերված ցանկում կանամիցին A-ից մինչև նեթիլմիցին ներկայացված են ամինոգլիկոզիդների շարքի 4,6-դեօքսիստրեպտամին երկտեղակալված ածանցյալների ենթադասը, նեոմիցինները 4,5-երկտեղակալված ենթադասի օրինակներ են, իսկ ստրեպտոմիցինը դեօքսիստրեպտամինային խմբից զուրկ ածանցյալ է[2]։
-
Կանամիցին A
-
Ամիկացին
-
Տոբրամիցին
-
Դիբեկացին
-
Սիսոմիցին
-
Նեթիլմիցին
-
Նեոմիցին B,C
-
Նեոմիցին E (պարոմոմիցին)
-
Պլազոմիցին
Ազդեցության մեխանիզմ
[խմբագրել | խմբագրել կոդը]
Ամինոգլիկոզիդները ունեն դեղաչափ կախյալ բակտերիասպան ակտիվություն գրամ բացասական աերոբ բակտերիաների մեծ մասի և ֆակուլտատիվ անաերոբ բացիլների նկատմամբ, բայց ոչ՝ գրամ բացասական անաերոբ և գրամ դրական բակտերիաների մեծ մասի նկատմամբ[3]։ Նրանք պահանջում են միայն կարճատև շփում և ամենաարդյունավետ ազդեցությունն են թողնում զգայուն բակտերիաների պոպուլյացիաների վրա, որոնք արագ են բազմանում[8]։ Այս ամենը վերաբերում է նրանց հիմնական ազդեցության մեխանիզմին ՝ սպիտակուցների սինթեզի ընկճմանը, մինչդեռ լրացուցիչ մեխանիզմները, որոնք վերագրված են որոշ ածանցյալներին, մանրակրկտորեն դեռ չեն նկարագրվել[2][3][8]։
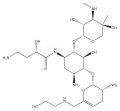
Սպիտակուցների սինթեզի ընկճումը միջնորդավորված է ամինոգլիկոզիդների էներգակախյալ, երբեմն անդարձելի կապով ցիտոզոլի, մեմբրանի հետ կապված բակտերիալ ռիբոսոմների հետ (պատկերը աջ կողմում)[2]։ Ամինոգլիկոզիդները սկզբում ներթափանցում են բակտերիայի բջջապատով (լիպոպոլիսախարիդը գրամ բացասական բակտերիաների մոտ) և բջջաթաղանթով, որտեղ նրանք տեղափոխվում են ակտիվ տրանսպորտի միջոցով[8]։ Թեև ախտահարված սպիտակուցի սինթեզի սպեցիֆիկ փուլերը կարող են տարբերվել սպեցիֆիկ ամինոգլիկոզիդային հատվածներից, ինչպես նաև տարբերվում է նրանց խնամակցությունը և կապման աստիճանը, այնուամենայնիվ ցիտոզոլում ամինոգլիկոզիդների առկայությունը խանգարում է սպիտակուցի շղթայի երկարացմանը՝ հատկապես ռիբոսոմի 30S ենթամիավորում, նպաստելով մՌՆԹ-ի ոչ ճիշտ տրանսկրիպցիայի և հետևաբար սպիտակուցների կենսասինթեզի խանգարման, որոնք արդյունքում սինթեզվում են կարճացած կամ որոշակի հատվածներում սխալ ամինաթթվային հաջորդականությամբ[2][8]։ Մասնավորապես դեղի կապումը խանգարում է տրանսլյացիոն գործընթացը առաջ բերելով ՌՆԹ-ի ինֆորմացիայի սխալ ընթերցմանը, վաղաժամ դադարեցմանը կամ երկուսը միաժամանակ, և դրանով իսկ նպաստում սխալ սպիտակուցի սինթեզին։ Վնասված սպիտակուցների քանակի մեծացումը մանրէի բջջապատում կարող է փոխել նրա թափանցելիությունը, այնուհետև նպաստել «ամինոգլիկոզիդների հետագա փոխադրման խթանման»[2]։ Մոլեկուլի ամինաշաքարային հատվածը (օրինակ՝ 2-դեօքսիստրեպտամինը կանամիցինում, գենտամիցինում և տոբրամիցինում, տե՛ս վերևում) ներգրավված է ռիբոսոմի և դեղի մոլեկուլի կապման գործընթացում, ինչն էլ առաջ է բերում տրանսլյացիայի խաթարման։
Նաև առաջարկվել է ռիբոսոմալ տրանսլոկացիայի ընկճման մեխանիզմը (պեպտիդիլ-ՌՆԹ-ի տեղաշարժը A-կայքից P-կայք)։ Կենդանի E. coli-ի մեկ մոլեկուլի վրա կատարված վերջին հետազոտությունները ցույց տվեցին սպիտակուցի սինթեզի շարունակական, սակայն դանդաղ ընթացք՝ տարբեր ամինոգլիկոզիդներով բուժման ընթացքում[9]։ Ստրեպտոմիցինը ունենալով նման քիմիական կառուցվածք, սակայն որոշակի առանձնահատկություններով հաճախ քննարկվում է ամինոգլիկոզիդների հետ, այն չի խափանում մՌՆԹ-ի տրանսլյացիան և հիմնականում զուրկ է բակտերիասպան ազդեցությունից[8]։
Առաջարկվել է նաև ամինոգլիկոզիդների մասնակցությունը մանրէի գենոմի գուանինային նուկլեոտիդների օքսիդացմանը, ինչի արդյունքում այս հակաբիոտիկները թողնում են ցիտոտոքսիկ ազդեցություն[10]։ Օքսիդացված գուանինի նուկլեոտիդների ընդգրկումը ԴՆԹ-ի մեջ կարող է բակտերիասպան ազդեցություն թողնել, քանի որ ԴՆԹ-ում սերտորեն տեղակայված 8-օքսո-2-դեօքսիգուանոզինի թերի վերականորոգումը կարող է հանգեցնել մահացու կրկնակի շղթաների ընդհատումների[10]։
Եվ վերջապես, հետագա «բջջաթաղանթային ազդեցությունը» նույնպես պայմանավորված է ամինոգլիկոզիդներով․ «բակտերիալ բջջային թաղանթի ֆունկցիոնալ ամբողջականությունը» ամինոգլիկոզիդների ընդունման ուշ շրջանում կարող է վերանալ[11]։
Ֆարմակոկինետիկա և ֆարմակոդինամիկա
[խմբագրել | խմբագրել կոդը]Կա զգալի տարբերություն ներմուծվող և վերջնական արյան պլազմայում առկա դեղաչափերի միջև։ Թերապևտիկ դեղի հսկումը անհրաժեշտ է ճիշտ դեղաչափի որոշման համար։ Այս դեղերը ունեն արտահայտված հետհակաբիոտիկային ազդեցություն, այսինքն արյան մեջ դեղի կոնցետրացիայի քիչ քանակության կամ ընդհանրապես բացակայության պայմաններում մանրէի աճը դեռևս ընկճված է։ Սա պայմանավորված է ռիբոսոմների հետ ամուր, անդարձելի կապերի առաջացումով։ Այս դեղերը երկար ժամանակ մնում են արյան պլազմայի մեջ, ինչը թույլ է տալիս երկարատև ընմիջումներ դեղաչափերի ընդունման միջև։ Կախված կոնցետրացիայից կարող են ունենալ բակտերիոստատիկ կամ բակտերիցիդ ազդեցություն[12]։
Ցուցումներ
[խմբագրել | խմբագրել կոդը]Ամինոգլիկոզիդները հատկապես արդյունավետ են այն վարակների բուժման համար, որոնք հարուցվում են աերոբ, գրամ բացասական բակտերիաներով, ինչպիսիք են Pseudomonas-ը, Acinetobacter-ը և Enterobacter-ը։ Բացի այդ, որոշ միկոբակտերիաներ, ներառյալ տուբերկուլոզ հարուցող բակտերիան նույնպես զգայուն են ամինոգլիկոզիդների նկատմամբ։ Չնայած ստրեպտոմիցինը առաջին էֆեկտիվ միջոցն էր տուբերկուլոզի բուժման համար, ստրեպտոմիցին ու ամիկացին ամինոգլիկոզիդների դերը ներկայումս նվազել է (վերջիններիս տոքսիկության և անհարմար կառավարման պատճառով), բացառությամբ բազմադեղորայքակայուն շտամների։ Ամինոգլիկոզիդների առավել տարածված կիրառումը էմպիրիկ կիրառումն է լուրջ վարակների ժամանակ, ինչպիսիք են սեպսիսը, ներորովայնային բարդացած վարակները, միզուղիների բարդացած վարակները և ներհիվանդանոցային շնչառական վարակները։ Սովորաբար, երբ օրգանիզմի կուլտուրաներն աճում են և դրանց զգայունությունը ստուգվում է, ամինոգիկոզիդների օգտագործումը դադարեցվում է՝ հօգուտ ավելի քիչ կողմնակի ազդեցությամբ հակաբիոտիկների։
Ինչպես արդեն նշվեց ամինոգլիկոզիդները հիմնականում անարդյունավետ են անաերոբ բակտերիաների, սնկերի և վիրուսների դեմ[2]։ Գրամ դրական բակտերիաներով հարուցված վարակները նույնպես կարող են բուժվել ամինոգլիկոզիդներով, սակայն հակաբիոտիկների այլ տեսակները ունեն ավելի ուժեղ և տիրոջ օրգանիզմի համար նվազ թունավոր ազդեցություն։ Նախկինում ամինոգլիկոզիդները կիրառվել են բետա-լակտամային հակաբիոտիկների հետ համատեղ ստրեպտոկոկային վարակների դեմ՝ իրենց սիներգիզմի շնորհիվ, հատկապես էնդոկարդիտի ժամանակ։ Առավել տարածված համակցումը ամիպիցիլինի (բետա-լակտամ կամ պենիցիլինի հետ կապված հակաբիոտիկ) և գենտամիցինի համակցումն է։ Հաճախ հիվանդանոցային աշխատակազմը այս համակցումը անվանում է «ամպ և գենտ», ավելի հազվադեպ՝ «պեն և գենտ», պենիցիլինի և գենտամիցինի համար։
Նոնսենս մուտացիա
[խմբագրել | խմբագրել կոդը]Միջամտությունը մՌՆԹ-ի ինֆորմացիայի ընթերցմանը կիրառվել է այն ժառանգական հիվանդությունների բուժման համար, որոնք առաջացել են վաղ տեղադրված ստոպ կոդոնների պատճառով՝ առաջ բերելով սպիտակուցի սինթեզի վաղ ավարտ և թերի սպիտակուցների սինթեզ։ Ամինագլիկոզիդները կարող են նպաստել բջջի կողմից ստոպ կոդոնների շրջանցմանը, պատահական ամինաթթուների ներդրմանը և լրիվ երկարություն ունեցող սպիտակուցների սինթեզին[13]։ Գենտամիցին ամինոգլիկոզիդը կիրառվել է լաբորատորիայում ցիստիկ ֆիբրոզով բջիջիների բուժման համար՝ լրիվ երկարությամբ սպիտակուցների սինթեզի դրդման նպատակով։ Ցիստիկ ֆիբրոզի պատճառը ցիստիկ ֆիբրոզի տրանսմեմբրանային հաղորդականության կարգավորիչ սպիտակուցը (CFTR) կոդավորող գենի մուտացիան է։ Ցիստիկ ֆիբրոզի մոտ 10% դեպքերում այս գենի մուտացիան բերում է տրանսլյացիայի վաղաժամ դադարեցման և կարճացած, ոչ ֆունկցիոնալ CFTR սպիտակուցի սինթեզին։ Ենթադրվում է, որ գենտամիցինը խախտում է ՌՆԹ-ի և ռիբոսոմի կոմպլեքսի կառուցվածքը, առաջ բերելով թարգմանվող կոդի սխալ ընթերցմանը, որն էլ նպաստում է ռիբոսոմի կողմից ստոպ կոդոնի հատվածի «բաց թողնմանը» և CFTR սպիտակուցի նորմալ երկարացմանը և սինթեզի շարունակմանը[14]։
Ներմուծման ուղիներ
[խմբագրել | խմբագրել կոդը]Քանի որ այս դեղերը չեն ներծծվում աղիքներից, նրանք ներմուծվում են ներերակային և միջմկանային ուղիներով։ Որոշները կիրառվում են որպես տեղային միջոց վերքերի բուժման համար։ Օրալ ներմուծումը կարող է կիրառվել աղիքների ախտահարման դեպքում (օր․՝ լյարդային էնցեֆալոպաթիայի ժամանակ)։ Տոբրամիցինը կարող է ներմուծվել սեղմումային ներշնչակների (նեբուլայզեր) ձևով[15]։
Կլինիկական կիրառում
[խմբագրել | խմբագրել կոդը]Վերջերս՝ գրամ բացասական բակտերիաների հակաբիոտիկային բարձր կայունություն ունեցող շտամներով հարուցված վարակների տարածումը, բժիշկներին դրդեց վերագնահատել այս հակաբիոտիկների օգտագործումը[16]։ Ամինոգլիկոզիդների օգտագործման նկատմամբ այս մեծ հետաքրքրությունը առաջ բերեց այս միացությունների հետ կապված երկու հիմնական հարցերի շուրջ բանավեճերին՝ հակաբիոտիկ զգայունությանը և թունավորությանը։ Ժամանակակից հետազոտությունները ցույց են տվել, որ ամինոգլիկոզիդները պահպանում են ակտիվությունը գրամ-բացասական կլինիկական բակտերիաների մեծ մասի նկատմամբ աշխարհի շատ մասերում։ Ամինոգլիկոզիդներով բուժման ընթացքում նեֆրոտոքսիկության և օտոտոքսիկության համեմատաբար հաճախակի առաջացումը ստիպում է բժիշկներին խուսափել այս դեղերի ամենօրյա կիրառումից։ Վերջերս կատարված թունավորության վրա ամինոգլիկոզիդների տարբեր դեղաչափերի սխեմաների ազդեցության բարելավումը մասնակի լուծում տվեց այս հարցին, սակայն դեռևս պետք է կատարվեն ավելի շատ հետազոտություններ այս խնդիրը լիովին լուծելու համար[17]։
Ամինոգլիկոզիդները պատկանում են հղիության D կատեգորիային, քանի որ կան պտղի վրա վտանգավոր ազդեցություն թողնող դրական արդյունքներ՝ հիմնված հետազոտական և շուկայավարման փորձի կամ մարդկանց վրա կատարված անբարենպաստ ռեակցիաների տվյալների վրա, սակայն հնարավոր օգտակար ազդեցությունները կարող են երաշխավորել դեղի օգտագործումը հղի կանանց մոտ՝ չնայած հավանական ռիսկերին[18]։
Անբարենպաստ ազդեցություններ
[խմբագրել | խմբագրել կոդը]Ամինոգլիկոզիդները կարող են վնասել ներքին ականջը՝ առաջ բերելով նեյրոսենսորային խլության առաջացմանը[19]։ Ներքին ականջի թունավորման հաճախականությունը տատանվում է 7-90%-ի սահմաններում և կախված է կիրառվող հակաբիոտիկի տեսակից, պացիենտի զգայունությունից տվյալ հակաբիոտիկի նկատմամբ և հակաբիոտիկի ներմուծման տևողությունից[20]։։
Ամինոգլիկոզիդների մեկ այլ լուրջ կողմնակի ազդեցություններից է վեստիբուլյար օտոտոքսիկությունը[19]։ Սա առաջ է բերում օսցիլոպսիայի (տեսողության անկայունություն) առաջացման և հավասարակշռության խախտման, որն ազդում է մարդկանց բոլոր տեսակի հավասարակշռային ֆունկցիաների խանգարման։ Այս խանգարումը ընդհանուր է և կարող է առաջանալ ցանկացած դեղաչափից[21][22][23][24]։
Ամինոգլիկոզիդների հաճախակի օգտագործումը կարող է առաջացնել երիկամի վնասում (սուր երիկայաին վնասում), որը կարող է հետագայում բերել երիկամի քրոնիկ հիվանդության[25]։
Հակացուցումներ
[խմբագրել | խմբագրել կոդը]Ամինոգլիկոզիդները կարող են նպաստել միասթենիա գրավիսով պացիենտների թուլության զգացողության ուժեղացմանը և այդ պատճառով այս պացիենտների շրջանում խրախուսված չէ նրանց օգտագործումը[26]։
Ամինոգլիկոզիդները հակացուցված են այն պացիենտների շրջանում, որոնք ունեն միտոքոնդրիալ հիվանդություններ, քանի որ նրանք կարող են միտոքոնդրիալ ԴՆԹ-ի սխալ տրանսլյացիայի պատճառ հանդիսանալ, դրանով իսկ բերելով անդարձելի լսոաղության կորստին, տինիտին, կարդոտոքսիկությանը և նեֆրոտոքսիկությանը։ Այնուամենայնիվ լսողության կորուստը և տինիտը դիտվել են նաև միտոքոնդրալ հիվանդություններ չունեցող պացիենտների մոտ[27]։
Ծանոթագրություններ
[խմբագրել | խմբագրել կոդը]- ↑ E.g., see www.merriam-webster.com/medical/aminoglycoside: "any of a group of antibiotics (as streptomycin and neomycin) that inhibit bacterial protein synthesis and are active especially against gram-negative bacteria".
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Mingeot-Leclercq MP, Glupczynski Y, Tulkens PM (1999). «Aminoglycosides: activity and resistance». Antimicrob. Agents Chemother. 43 (4): 727–37. doi:10.1128/AAC.43.4.727. PMC 89199. PMID 10103173.
- ↑ 3,0 3,1 3,2 ME Levison, MD, 2012, Aminoglycosides, The Merck Manual [1], accessed 22 February 2014.
- ↑ Kroppenstedt RM, Mayilraj S, Wink JM (2005 թ․ հունիս). «Eight new species of the genus Micromonospora, Micromonospora citrea sp. nov., Micromonospora echinaurantiaca sp. nov., Micromonospora echinofusca sp. nov. Micromonospora fulviviridis sp. nov., Micromonospora inyonensis sp. nov., Micromonospora peucetia sp. nov., Micromonospora sagamiensis sp. nov., and Micromonospora viridifaciens sp. nov». Syst Appl Microbiol. 28 (4): 328–39. doi:10.1016/j.syapm.2004.12.011. PMID 15997706.
- ↑ Paul M. Dewick (2009). Medicinal Natural Products: A Biosynthetic Approach (3rd ed.). Wiley. ISBN 978-0-470-74167-2.
- ↑ Walter P. Hammes1 and Francis C. Neuhaus (1974). «On the Mechanism of Action of Vancomycin: Inhibition of Peptidoglycan Synthesis in Gaffkya homari». Antimicrobial Agents and Chemotherapy. 6 (6): 722–728. doi:10.1128/AAC.6.6.722. PMC 444726. PMID 4451345.
{{cite journal}}: CS1 սպաս․ թվային անուններ: authors list (link) - ↑ The Mechanism of Action of Macrolides, Lincosamides and Streptogramin B Reveals the Nascent Peptide Exit Path in the Ribosome Martin Lovmar and Måns Ehrenberg
- ↑ 8,0 8,1 8,2 8,3 8,4 DVM Boothe, DVM, PhD, 2012, Aminoglycosides (Aminocyclitols), The Merck Veterinary Manual «Aminoglycosides: Antibacterial Agents: Merck Veterinary Manual». Արխիվացված է օրիգինալից 2014 թ․ մարտի 1-ին. Վերցված է 2014 թ․ փետրվարի 22-ին., accessed 22 February 2014.
- ↑ Aguirre Rivera, Javier (2021). «Real-time measurements of aminoglycoside effects on protein synthesis in live cells». Proceedings of the National Academy of Sciences. 118 (9): e2013315118. doi:10.1073/pnas.2013315118. PMC 7936356. PMID 33619089.
- ↑ 10,0 10,1 Foti JJ, Devadoss B, Winkler JA, Collins JJ, Walker GC. Oxidation of the guanine nucleotide pool underlies cell death by bactericidal antibiotics. Science. 2012 Apr 20;336(6079):315-9. doi: 10.1126/science.1219192. PMID 22517853; PMCID: PMC3357493
- ↑ As Boothe notes, "high concentrations of aminoglycosides may cause nonspecific membrane toxicity, even to the point of bacterial cell lysis", though the physiologic relevance of these concentrations to specific clinical situations is unclear. DVM Boothe, DVM, PhD, 2012, Aminoglycosides (Aminocyclitols), The Merck Veterinary Manual «Aminoglycosides: Antibacterial Agents: Merck Veterinary Manual». Արխիվացված է օրիգինալից 2014 թ․ մարտի 1-ին. Վերցված է 2014 թ․ փետրվարի 22-ին., accessed 22 February 2014.
- ↑ «Aminoglycosides - Infectious Diseases». MSD Manual Professional Edition (անգլերեն). Վերցված է 2021 թ․ դեկտեմբերի 14-ին.
- ↑ Feero, W. Gregory; Guttmacher, Alan E.; Dietz, Harry C. (2010). «New Therapeutic Approaches to Mendelian Disorders». New England Journal of Medicine. 363 (9): 852–63. doi:10.1056/NEJMra0907180. PMID 20818846. S2CID 5809127.
- ↑ Wilschanski, Michael; Yahav, Yaacov; Yaacov, Yasmin; Blau, Hannah; Bentur, Lea; Rivlin, Joseph; Aviram, Micha; Bdolah-Abram, Tali; և այլք: (2003). «Gentamicin-Induced Correction of CFTR Function in Patients with Cystic Fibrosis and CFTR Stop Mutations». New England Journal of Medicine. 349 (15): 1433–41. doi:10.1056/NEJMoa022170. PMID 14534336.
- ↑ Pai VB, Nahata MC (2001 թ․ հոկտեմբեր). «Efficacy and safety of aerosolized tobramycin in cystic fibrosis». Pediatr. Pulmonol. 32 (4): 314–27. doi:10.1002/ppul.1125. PMID 11568993. S2CID 30108514.
- ↑ Falagas, Matthew E; Grammatikos, Alexandros P; Michalopoulos, Argyris (2008). «Potential of old-generation antibiotics to address current need for new antibiotics». Expert Review of Anti-infective Therapy. 6 (5): 593–600. doi:10.1586/14787210.6.5.593. PMID 18847400. S2CID 13158593.
- ↑ Durante-Mangoni, Emanuele; Grammatikos, Alexandros; Utili, Riccardo; Falagas, Matthew E. (2009). «Do we still need the aminoglycosides?». International Journal of Antimicrobial Agents. 33 (3): 201–5. doi:10.1016/j.ijantimicag.2008.09.001. PMID 18976888.
- ↑ Merck Manual: Bacteria and Antibacterial Drugs: Aminoglycosides Last full review/revision July 2009 by Matthew E. Levison, MD
- ↑ 19,0 19,1 Selimoglu, Erol (2007). «Aminoglycoside-induced ototoxicity». Current Pharmaceutical Design. 13: 119–126. doi:10.2174/138161207779313731. PMID 17266591.
- ↑ L, Peterson; C, Rogers (2015 թ․ փետրվարի 18). «Aminoglycoside-induced hearing deficits – a review of cochlear ototoxicity». South African Family Practice. 57 (2): 77–82. doi:10.1080/20786190.2014.1002220.
- ↑ Black, FO; Pesznecker, S; Stallings, V (2004 թ․ հուլիս). «Permanent gentamicin vestibuloxicity». Otology and Neurotology. 25 (4): 559–69. doi:10.1097/00129492-200407000-00025. PMID 15241236. S2CID 40285162.
- ↑ Ahmed, RM; Hannigan, IP; MacDougall, HG; Chan, RC; Halmagyi, GM (2012 թ․ հունիսի 18). «Gentamicin ototoxicity: a 23-year selected case series of 103 patients». Medical Journal of Australia. 196 (11): 701–4. doi:10.5694/mja11.10850. PMID 22554194.
- ↑ Ahmed, RM; MacDougall, HG; Halmagyi, GM (2011 թ․ սեպտեմբեր). «Unilateral vestibular loss due to systemically administered gentamicin». Otology and Neurotology. 32 (7): 1158–62. doi:10.1097/MAO.0b013e31822a2107. PMID 21844784. S2CID 1412868.
- ↑ Ishiyama, G; Ishimaya, A; Kerber, K; Baloh, RW (2006 թ․ հոկտեմբեր). «Gentamicin ototoxicity: clinical features and the effect on the human vestibulo-ocular reflex». Acta Otolaryngologica. 126 (10): 1057–61. doi:10.1080/00016480600606673. PMID 16923710. S2CID 5883996.
- ↑ Prayle A, Watson A, Fortnum H, Smyth A (2010 թ․ հուլիս). «Side effects of aminoglycosides on the kidney, ear and balance in cystic fibrosis». Thorax. 65 (7): 654–8. doi:10.1136/thx.2009.131532. PMC 2921289. PMID 20627927.
- ↑ Gautam Mehta and Bilal Iqbal. Clinical Medicine for the MRCP PACES. Volume 1. Core Clinical Skills. Oxford University Press. 2010.
- ↑ referenced in Bindu, LH; Reddy, PP (2008). «Genetics of aminoglycoside-induced and prelingual non-syndromic mitochondrial hearing impairment: a review». Int J Audiol. 47 (11): 702–7. doi:10.1080/14992020802215862. PMID 19031229. S2CID 25797666. See Also Fischel-Ghodsian, N (1999). «Genetic factors in aminoglycoside toxicity». Ann N Y Acad Sci. 884: 99–109. doi:10.1111/j.1749-6632.1999.tb08639.x. PMID 10842587. S2CID 10280462.
Արտաքին հղումներ
[խմբագրել | խմբագրել կոդը]| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ամինոգլիկոզիդներ» հոդվածին։ |
|
- MedlinePlus drug information - Aminoglycosides (Systemic)
- Science Daily Bacterial 'Battle for Survival' - Rhodostreptomycin