Hofmann-lebontás
A Hofmann-lebontás szerves kémiai reakció, melynek során egy primer amidból egy szénatommal rövidebb láncú primer amin keletkezik.[1][2][3][4]
A reakciót felfedezőjéről, August Wilhelm von Hofmannról nevezték el. Nem keverendő össze a Hofmann-eliminációval.
Mechanizmus
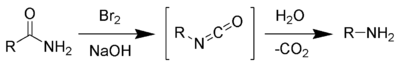
[szerkesztés]Bróm és nátrium-hidroxid reakciójával in situ nátrium-hipobromit keletkezik, mely a primer amidot izocianát köztitermékké alakítja. Az izocianát hidrolízisével, szén-dioxid kilépése közben primer amin keletkezik:
Változatai
[szerkesztés]A bróm számos más reagenssel helyettesíthető. N-brómszukcinimid (NBS) és 1,8-diazabiciklo[5.4.0]undec-7-én (DBU) hatására is végbemehet a Hofmann-lebontás. Az alábbi példában a keletkező izocianátot metanollal csapdázzák, így az karbamáttá alakul.[5]
Hasonló módon az izocianát köztitermék terc-butanollal is csapdázható, ekkor t-butoxikarbonil (Boc) csoporttal védett amin keletkezik.
Brómnál enyhébb reagensként (bisz(trifluoracetoxi)jód)benzol is használható.[6]
Felhasználása
[szerkesztés]- Alifás és aromás amidok alifás és aromás aminokká alakítása
- Antranilsav ftálimidből történő előállítása
- Nikotinsavból 3-aminopiridin előállítása
- Az α-fenil-propánamid kiralitáscentrumának konfigurációja nem változik meg a Hofmann-lebontás után (a reakció retencióval jár)
Fordítás
[szerkesztés]Ez a szócikk részben vagy egészben a Hofmann rearrangement című angol Wikipédia-szócikk ezen változatának fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét és a szerzői jogokat jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
Hivatkozások
[szerkesztés]- ↑ Hofmann, A. W. v. (1881). „{{{title}}}”. Ber. 14, 2725. o.
- ↑ Wallis, E. S.; Lane, J. F. (1949). „{{{title}}}”. Org. React. 3, 267–306. o.
- ↑ Shioiri, T. (1991). „{{{title}}}”. Comp. Org. Syn. 6, 800–806. o.
- ↑ Antus Sándor, Mátyus Péter. Szerves kémia II.. Budapest: Nemzeti Tankönyvkiadó, 282. o. (2005). ISBN 963 19 5714 4
- ↑ Keillor, J. W.; Huang, X. (2004). „Methyl Carbamate Formation via Modified Hofmann Rearrangement Reactions: Methyl N-(p-Methoxyphenyl)carbamate”. Org. Synth..; Coll. Vol. 10: 549
- ↑ Almond, M. R.; Stimmel, J. B.; Thompson, E. A.; Loudon, G.M. (1993). „Hofmann Rearrangement under Mildly Acidic Conditions using [I,I-Bis(Trifluoroacetoxy)]iodobenzene: Cyclobutylamine Hydrochloride from Cyclobutanecarboxamide”. Org. Synth..; Coll. Vol. 8: 132
Külső hivatkozások
[szerkesztés]Források
[szerkesztés]- Clayden, Jonnathan. Organic Chemistry. Oxfort University Press Inc., 1073. o. (2007). ISBN 978-0-19-850346-0
- Fieser, Louis F.. Advanced Organic Chemistry. Reinhold Publishing Corporation, Chapman & Hall, Ltd., 499–501. o. (1962)