Uracile-ADN glycosylase
| N° EC | EC |
|---|
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
L'uracile-ADN glycosylase (UDG ou UNG) est une glycosylase qui clive l'uracile présent dans l'ADN et amorce la réparation de l'ADN par excision de base. Ce faisant, elle prévient la mutagenèse en éliminant l'uracile présent dans l'ADN ; l'uracile peut résulter de la désamination spontanée de la cytosine, une réaction fréquente en conditions oxydantes. Ceci est important car le potentiel mutagène d'un résidu d'uracile se propage lors de la réplication de l'ADN[2] : l'uracile s'apparie en effet avec l'adénine alors que la cytosine s'apparie avec la guanine, de sorte que la conversion d'un résidu cytosine en uracile peut conduire au remplacement, dans l'une des deux molécules d'ADN bicaténaires après réplication, d'une paire guanine–cytosine par une paire adénine–uracile[3]. Cette enzyme est très spécifique et très rapide, de sorte qu'elle peut cliver chaque jour plus de 10 000 résidus d'uracile sur l'ADN dans une cellule humaine[4]. Les cellules humaines expriment cinq à six types d'ADN glycosylases différents, qui partagent toutes un mécanisme de clivage commun comme moyen de réparer l'ADN[5], et sont chacune spécifique d'un type de lésion de base.
Mécanisme
[modifier | modifier le code]Les uraciles ne sont pas des bases naturellement présentes dans l'ADN, mais résultent principalement de la modification chimique des cytosines par désamination. L'uracile-ADN glycosylase hydrolyse la liaison N-glycosidique entre le carbone 1' du désoxyribose et la position N3 de ces uraciles anormalement présents dans l'ADN. Les produits de la réaction sont de l'uracile libre et un brin d'ADN contenant un site abasique ou site AP. En reconnaissant spécifiquement les uraciles, cette enzyme permet l'élimination de cette lésion fréquente de l'ADN.
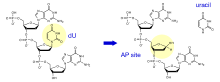
Le site abasique est ensuite pris en charge par le mécanisme générique de réparation par excision de base qui implique entre autres la resynthèse de la base altérée par une ADN polymérase.
Notes et références
[modifier | modifier le code]- (en) Sudip S. Parikh, Clifford D. Mol, Geir Slupphaug, Sangeeta Bharati, Hans E. Krokan et John A. Tainer, « Base excision repair initiation revealed by crystal structures and binding kinetics of human uracil‐DNA glycosylase with DNA », EMBO Journal, vol. 17, no 17, , p. 5214-5226 (PMID 9724657, PMCID 1170849, DOI 10.1093/emboj/17.17.5214, lire en ligne)
- (en) Mary C. Longo, Mark S. Berninger et James L. Hartley, « Use of uracil DNA glycosylase to control carry-over contamination in polymerase chain reactions », Gene, vol. 93, no 1, , p. 125-128 (PMID 2227421, DOI 10.1016/0378-1119(90)90145-H, lire en ligne)
- (en) Laurence H Pearl, « Structure and function in the uracil-DNA glycosylase superfamily », Mutation Research/DNA Repair, vol. 460, nos 3-4, , p. 165-181 (PMID 10946227, DOI 10.1016/S0921-8777(00)00025-2, lire en ligne)
- (en) Geir Slupphaug, Clifford D. Mol, Bodil Kavli, Andrew S. Arvai, Hans E. Krokan et John A. Tainer, « A nucleotide-flipping mechanism from the structure of human uracil–DNA glycosylase bound to DNA », Nature, vol. 384, no 6604, , p. 87-92 (PMID 8900285, DOI 10.1038/384087a0, lire en ligne)
- (en) Tomas Lindahl, « Suppression of spontaneous mutagenesis in human cells by DNA base excision–repair », Mutation Research/Reviews in Mutation Research, vol. 462, nos 2-3, , p. 129-135 (PMID 10767624, DOI 10.1016/S1383-5742(00)00024-7, lire en ligne)

