Chlorure de thorium(IV)
| Chlorure de thorium(IV) | |
| |
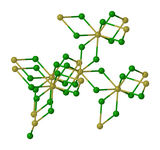
| Structure du chlorure de thorium(IV) | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.039 |
| No CE | 233-056-1 |
| No RTECS | XO6475000 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | aiguilles blanches hygroscopique |
| Propriétés chimiques | |
| Formule | ThCl4 |
| Masse molaire[1] | 373,85 ± 0,008 g/mol Cl 37,93 %, Th 62,07 %, |
| Propriétés physiques | |
| T° fusion | 770 °C |
| T° ébullition | 921 °C |
| Masse volumique | 4,59 g/cm3 |
| Cristallographie | |
| Système cristallin | tétragonal |
| Écotoxicologie | |
| DL50 | 332 mg/kg (intrapéritonéal, souris) |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le chlorure de thorium(IV) désigne une famille de composés inorganiques de formule ThCl4(H2O)n. Les formes anhydre et tétrahydrate (n = 4) sont connues. Ce sont des sels blancs hygroscopiques, solubles dans l'eau.
Structure
[modifier | modifier le code]
La structure du chlorure de thorium(IV) possède des centres Th octa-coordonnés avec des ligands chlorure doublement pontants[2].
Synthèse
[modifier | modifier le code]ThCl4 fut un intermédiaire dans le premier isolement du thorium métallique par Jons Jacob Berzelius[3].
Le chlorure de thorium(IV) peut être produit de différentes manières. Une des méthode est la réaction carbothermique, entre 700 °C et 2600 °C, impliquant des oxydes de thorium et du carbone dans un flux de chlore gazeux :
- ThO2 + 2 C + 4 Cl2 → ThCl4 + 2 CO
La réaction de chloration peut être effectuée avec du tétrachlorure de carbone[4],[5] :
- Th(C2O4)2 + CCl4 → ThCl4 + 3 CO + 3 CO2
Dans une autre méthode en deux étapes, le thorium métallique réagit avec du chlorure d'ammonium :
- Th + 6 NH4Cl → (NH4)2ThCl6 + 4 NH3 + 2 H2
Le sel hexachlorure est ensuite chauffé à 350 °C sous vide poussé pour produire ThCl4[6].
Réactions
[modifier | modifier le code]- Adduits de bases de Lewis
ThCl4 réagit avec les bases de Lewis pour donner des adduits moléculaires, tels que ThCl4(DME)2 et ThCl4(TMEDA)2[6].
- Réduction en Th métallique
Le chlorure de thorium(IV) est un intermédiaire dans la purification du thorium, qui peut être effectuée par :
- Réduction de ThCl4 par des métaux alcalins.
- Electrolyse du chlorure de thorium(IV) anhydre dans un mélange fondu de NaCl et de KCl.
- Réduction au Ca d'un mélange de ThCl4 et du chlorure de zinc anhydre[7].
Références
[modifier | modifier le code]- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) J. T. Mason, M. C. Jha et P. Chiotti, « Crystal Structures of ThCl4 Polymorphs », Journal of the Less Common Metals, vol. 34, , p. 143–151 (DOI 10.1016/0022-5088(74)90224-0)
- ↑ (en) Mary Elvira Weeks, « The Discovery of the Elements. XI. Some Elements Isolated with the Aid of Potassium and Sodium: Zirconium, Titanium, Cerium, and Thorium », Journal of Chemical Education, vol. 9, no 7, , p. 1231 (ISSN 0021-9584, DOI 10.1021/ed009p1231, Bibcode 1932JChEd...9.1231W)
- ↑ (en) Georg Brauer, Handbook Of Preparative Inorganic Chemistry, New York, Academic Press,
- ↑ (en) R. L. Gutierrez et R. J. Herbst, « Preliminary Fabrication Studies of Alternative LMFBR Carbide Fuels », Los Alamos Scientific Laboratory, (DOI 10.2172/5688597, lire en ligne)
- (en) Thibault Cantat, Brian L. Scott et Jaqueline L. Kiplinger, « Convenient Access to the Anhydrous Thorium Tetrachloride Complexes ThCl4(DME)2, ThCl4(1,4-dioxane)2 and ThCl4(THF)3.5 using Commercially Available and Inexpensive Starting Materials », Chemical Communications, vol. 46, no 6, , p. 919–21 (ISSN 1364-548X, PMID 20107650, DOI 10.1039/b923558b, lire en ligne)
- ↑ (en) « Periodic Table of Elements: Los Alamos National Laboratory », sur periodic.lanl.gov (consulté le )
