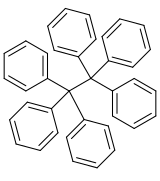
Hexaphenylethan
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hexaphenylethan | ||||||||||||
| Andere Namen |
1,1,1,2,2,2-Hexaphenylethan (IUPAC) | ||||||||||||
| Summenformel | C38H30 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 486,658 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Hexaphenylethan ist eine hypothetische organische Verbindung, die aus einem sechsfach phenylsubstituiertem Ethanzentrum besteht. Allerdings war bisher kein Syntheseversuch erfolgreich.[2] Ursprünglich wurde gedacht, Hexaphenylethan durch Dimerisierung des freien Tritylradikals erhalten zu können. NMR-spektroskopische Experimente zeigten jedoch, dass in der Realität das asymmetrische Gombergs Dimer entsteht. Ein Hauptgrund gegen eine symmetrische Dimerisierung ist dabei ein zu hoher sterischer Anspruch der Phenylgruppen.
Allerdings war es möglich ein substituiertes Derivat, Hexakis(3,5-di-t-butylphenyl)ethan zu synthetisieren. Dieses zeichnet sich durch einen mit 167 pm im Vergleich zu typischen Einfachbindungen (154 pm) sehr großen C–C Abstand der zentralen Kohlenstoffatome aus. Es wird angenommen, dass London-Dispersionswechselwirkungen zwischen den tert-Butylsubstituenten zentrale Beiträge für die Stabilität dieses sterisch gehinderten Moleküls leisten.[3]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]- Tetraphenylmethan
- Hexaphenyldisilan (synthetisierbares siliciumorganisches Analogon)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Errol G. Lewars: Modeling Marvels. 2008, ISBN 978-1-4020-6973-4, Chapter 8: Hexaphenylethane, S. 115–129.
- ↑ Sören Rösel, Ciro Balestrieri, Peter R. Schreiner: Sizing the role of London dispersion in the dissociation of all-meta tert-butyl hexaphenylethane. In: Chemical Science. 8. Jahrgang, Nr. 1, 2017, S. 405–410, doi:10.1039/C6SC02727J, PMC 5365070 (freier Volltext) – (englisch, rsc.org).
Literatur
[Bearbeiten | Quelltext bearbeiten]- Yasuto Uchimura, Takashi Takeda, Ryo Katoono, Kenshu Fujiwara, Takanori Suzuki: Inside Back Cover: New Insights into the Hexaphenylethane Riddle: Formation of an α,o-Dimer. In: Angewandte Chemie International Edition. 54. Jahrgang, Nr. 13, 2015, S. 4125, doi:10.1002/anie.201501649.