Dodecano-1,5-lacton
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
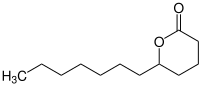
| ||||||||||
| Unspezifizierte Stereochemie | ||||||||||
| Allgemeines | ||||||||||
| Name | Dodecano-1,5-lacton | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C12H22O2 | |||||||||
| Kurzbeschreibung |
farblose Flüssigkeit[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 198,30 g·mol−1 | |||||||||
| Aggregatzustand |
flüssig[1] | |||||||||
| Dichte |
0,942 g·cm−3 (25 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Siedepunkt | ||||||||||
| Löslichkeit |
| |||||||||
| Brechungsindex |
1,460 (20 °C)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Toxikologische Daten | ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||
Dodecano-1,5-lacton (auch Dodecan-1,5-olid oder δ-Dodecanolacton) ist eine organische Verbindung aus der Gruppe der Lactone.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Dodecano-1,5-lacton wird in unterschiedlicher Zusammensetzung der Enantiomeren von mehreren Pflanzen gebildet. In Kokosnüssen tritt es mit 52 % (R)-Isomer praktisch racemisch auf, in Erdbeeren weist es mit 69 % (R)-Isomer einen deutlichen Enantiomerenüberschuss auf.[3] Es wird außerdem von Lactobacillus plantarum gebildet.[4] Dodecano-1,5-lacton kommt auch in Milchprodukten wie Milch, Schlagsahne, Butter und Käse vor, wobei es zu über 90 % als (R)-Enantiomer vorliegt.[5]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Dodecano-1,5-lacton kann ausgehend von Cyclopentanon hergestellt werden. Dazu wird dieses zunächst mit N,N-Dimethylhydrazin in ein Hydrazon umgewandelt. Durch Umsetzung mit Butyllithium und 1-Bromheptan und saure Aufarbeitung entsteht 2-Heptylcyclopentanon. Dieses kann durch Baeyer-Villiger-Oxidation mit Magnesiummonoperoxyphthalat in Dodecano-1,5-lacton umgewandelt werden.[6] Eine Alternative Methode ist die Baeyer-Villiger-Oxidation von Heptylcyclopentanon mit Wasserstoffperoxid als Oxidationsmittel, Toluol als Lösungsmittel und mit Zinn(II)-chlorid modifizierter Bentonit als Katalysator.[7] Die analoge biotechnologische Baeyer-Villiger-Oxidation gelingt mit dem Organismus Acinetobacter calcoaceticus in Gegenwart von Tetraethylpyrophosphat.[8] Reaktion von Cyclopentanon mit einem Aldehyd im Basischen ergibt ein 2-Alkylidencyclopentanon. Durch Hydrierung an Palladium und Baeyer-Villiger-Oxidation werden δ -Lactone erhalten. Durch Reaktion mit Heptanal über 2-Heptylidencyclopentanon wird so ebenfalls Dodecano-1,5-lacton erhalten.[9]
Die reinen Enantiomere können ausgehend vom N-Benzylamid der 5-Hydroxydodecansäure hergestellt werden. Dieses wird zunächst durch Dimethylaminopyridin und EDCI in Tetrahydrofuran mit Boc-geschütztem Alanin verestert. Dadurch entstehen Diastereomere, die chromatografisch getrennt werden können. Durch diese Trennung können beide Verbindungen jeweils zu einem enantiomerenreinen Lacton umgesetzt werden. Dazu werden durch Reaktion mit Natriumhydroxid in Methanol zunächst die Schutzgruppen entfernt und anschließend mit Schwefelsäure in Methanol ein Methylester hergestellt. Durch Umesterung / Lactonisierung mit para-Toluolsulfonsäure und einem Molsieb in Toluol wird das Lacton erhalten.[10] Eine alternative Synthese für die reinen Enantiomere geht analog zur oben beschriebenen nicht enantioselektiven Methode von 2-Heptylidencyclopentanon aus. Asymmetrische Noyori-Hydrierung mit Wasserstoff und einem Ruthenium / BINAP-Katalysator ergibt enantiomerenreines 2-Heptylcyclopentanon. Dieses kann unter Erhalt der Stereochemie in einer Baeyer-Villiger-Oxidation mit meta-Chlorperbenzoesäure in Dodecano-1,5-lacton überführt werden.[11]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Verbindung wirkt fungizid, insbesondere gegen Schimmelpilze wie Aspergillus flavus und Aspergillus fumigatus.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Dodecano-1,5-lacton wird weltweit in der Größenordnung von 10 bis 100 Tonnen pro Jahr als Duftstoff verwendet.[12] Es ist in der EU unter der FL-Nummer 10.008 als Aromastoff für Lebensmittel zugelassen.[13]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j Datenblatt d-Dodecalakton, mixture of isomers, natural, ≥98%, FG bei Sigma-Aldrich, abgerufen am 15. September 2024 (PDF).
- ↑ a b George A. Burdock: Fenaroli's Handbook of Flavor Ingredients. CRC Press, 2004, ISBN 978-1-4200-3787-6, S. 515 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Alexander Bernreuther, Jürgen Bank, Gerhard Krammer, Peter Schreier: Multidimensional gas chromatography/mass spectrometry: A powerful tool for the direct chiral evaluation of aroma compounds in plant tissues I. 5‐alkanolides in fruits. In: Phytochemical Analysis. Band 2, Nr. 1, Februar 1991, S. 43–47, doi:10.1002/pca.2800020109.
- ↑ a b E.J. Yang, Y.-S. Kim, H.C. Chang: Purification and Characterization of Antifungal δ-dodecalactone from Lactobacillus plantarum AF1 Isolated from Kimchi. In: Journal of Food Protection. Band 74, Nr. 4, April 2011, S. 651–657, doi:10.4315/0362-028X.JFP-10-512.
- ↑ Detmar Lehmann, Birgit Maas, Armin Mosandl: Stereoisomeric flavour compounds LXIX: stereodifferentiation of δ(γ)-lactones C8–C18 in dairy products, margarine and coconut. In: Zeitschrift für Lebensmittel-Untersuchung und -Forschung. Band 201, Nr. 1, Januar 1995, S. 55–61, doi:10.1007/BF01193201.
- ↑ Takashi Mino, Satoshi Masuda, Masayuki Nishio, Masakazu Yamashita: Synthesis of Lactones by Baeyer−Villiger Oxidation with Magnesium Monoperphthalate Hexahydrate. In: The Journal of Organic Chemistry. Band 62, Nr. 8, 1. April 1997, S. 2633–2635, doi:10.1021/jo9623043.
- ↑ Qingguo Ma, Lei Li, Yongxing Cao, Xinhua Peng: Sn–bentonite-induced Baeyer–Villiger oxidation of 2-heptylcyclopentanone to δ-dodecalactone with aqueous hydrogen peroxide. In: Research on Chemical Intermediates. Band 41, Nr. 4, April 2015, S. 2249–2256, doi:10.1007/s11164-013-1342-6.
- ↑ Véronique Alphand, Alain Archelas, Roland Furstoss: Microbiological Transformations 15. The Enantioselective Microbiological Baeyer-Villiger Oxidation of Alpha-Substituted Cyclopentanones. In: Biocatalysis. Band 3, Nr. 1-2, Januar 1990, S. 73–83, doi:10.3109/10242429008992050.
- ↑ Akié Ijima, Kiyoshi Takahashi: Synthèse de δ-Lactones. IV. Alcoyl-6 et Aralcoyl-6 δ-Lactones à Partir de la Cyclopentanone. 2. In: Chemical and Pharmaceutical Bulletin. Band 21, Nr. 1, 1973, S. 215–219, doi:10.1248/cpb.21.215.
- ↑ Yasutaka Shimotori, Masayuki Hoshi, Syota Seki, Takeshi Osanai, Hayato Okabe, Yoshitaka Ikeda, Tetsuo Miyakoshi: Preparation of Optically Pure δ-Lactones Using Diastereomeric Resolution with Amino Acid as Resolving Agent. In: Journal of Oleo Science. Band 64, Nr. 1, 2015, S. 75–90, doi:10.5650/jos.ess14124.
- ↑ Takeshi Yamamoto, Miharu Ogura, Akira Amano, Kenichiro Adachi, Toshimitsu Hagiwara, Tsuneyoshi Kanisawa: Synthesis and odor of optically active 2-n-hexyl- and 2-n-heptylcyclopentanone and the corresponding δ-lactones. In: Tetrahedron Letters. Band 43, Nr. 50, Dezember 2002, S. 9081–9084, doi:10.1016/S0040-4039(02)02312-2.
- ↑ A.M. Api, D. Belsito, D. Botelho, M. Bruze, G.A. Burton, J. Buschmann, M.A. Cancellieri, M.L. Dagli, M. Date, W. Dekant, C. Deodhar, A.D. Fryer, L. Jones, K. Joshi, M. Kumar, A. Lapczynski, M. Lavelle, I. Lee, D.C. Liebler, H. Moustakas, M. Na, T.M. Penning, G. Ritacco, J. Romine, N. Sadekar, T.W. Schultz, D. Selechnik, F. Siddiqi, I.G. Sipes, G. Sullivan, Y. Thakkar, Y. Tokura: RIFM fragrance ingredient safety assessment, δ-dodecalactone, CAS Registry Number 713-95-1. In: Food and Chemical Toxicology. Band 153, Juli 2021, S. 112295, doi:10.1016/j.fct.2021.112295.
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 13. September 2024.
