Organojodidy
Organojodidy jsou organické sloučeniny obsahující vazby mezi atomy uhlíku a jodu. Jsou časté v organické chemii, ale v přírodě poměrně vzácné; patří sem například hormony štítné žlázy.
Struktura a vlastnosti
[editovat | editovat zdroj]Organojodidy jsou mnohdy považovány za deriváty I−.[1]
Vazba C-I je nejslabší ze všech vazeb uhlík–halogen, což odpovídá snižování elektronegativity halogenů v řadě F > Cl > Br > I. Obdobně se i zvětšují atomové poloměry a délky vazeb C-X. U sloučenin CH3X, kde X je halogen, jsou disociační energie vazby 482 kJ/mol u F, 350 kJ/mol u Cl, 302 kJ/mol u Br a 241 kJ/mol u I.[2]
Jodidy jsou obvykle ze všech halogenidů nejlepšími odstupujícími skupinami. Vzhledem k nízkým energiím vazeb C–I jsou vzorky organojodidů často zabarvené do žluta příměsemi I2.
Významnou vlastností organických sloučenin jodu je jejich vysoká hustota vyplývající z velké atomové hmotnosti jodu, například 1 cm3 dijodmethanu má hmotnost 3,325 g.
Použití v průmyslu
[editovat | editovat zdroj]Průmyslový význam, z hlediska výroby ve velkých množstvích, má jen několik organických sloučenin jodu. Meziprodukty obsahující jod jsou běžné v organické syntéze, což je způsobeno snadným štěpením vazby C-I. Průmyslově významnými, často jako dezinfekční prostředky nebo pesticidy, jsou jodoform (CHI3), dijodmethan (CH2I2) a jodmethan (CH3I).[3] I když jodmethan nemá velký význam jako produkt, tak je důležitým meziproduktem při výrobě kyseliny octové a jejího anhydridu. Jodmethan by mohl nahradit brommethan jako fumigant, jeho dopad na životní prostředí ovšem není dobře prozkoumán.[4] Ioxynil (3,5-dijod-4-hydroxybenzonitril), který inhibuje fotosyntézu skrze fotosystém II, je jedním z mála používaných organojodidových herbicidů. Jako jeden z hydroxybenzonitrilových herbicidů je ioxynil jodovaným analogem organobromidu bromoxynilu (3,5-dibrom-4-hydroxybenzonitrilu).
Jodované a bromované organické sloučeniny jsou předmětem obav, protože není dobře známo, co se s nimi děje v životním prostředí. Byla popsána biologická dekontaminace těchto látek, například enzym jodtyrosindejodáza u savců dokáže provádět aerobní redukční dehalogenace jodovaných a bromovaných organických substrátů.[5] Bromoxynil a jodoxynil procházejí řadou různých přeměn, jako jsou redukční dehalogenace anaerobními bakteriemi.[6]
Polyjodované organické sloučeniny se používají jako rentgenové kontrastní látky při vyšetřeních fluoroskopií, kde se využívá schopnost těžkých jader jodu pohlcovat rentgenové záření.
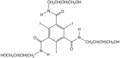
Dostupný je velký počet takových sloučenin, jako příklady lze uvést 1,3,5-trijodbenzen, který obsahuje kolem 50 hmotnostních procent jodu. Ve většině případů musí být tyto látky dobře rozpustné ve vodě, netoxické a snadno vyloučitelné. Jedním z takových reaktantů je ioversol (na obrázku vpravo),[7] obsahující diolové skupiny usnadňující rozpouštění. Využití má v urografii a angiografii.
Organojodná maziva lze použít na titan, nerezovou ocel a jiné kovy: organojodidy mohou být použity v turbínách, kosmických lodích a jako složky řezných olejů při obrábění.[8]
-
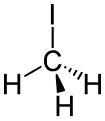
Jodmethan, prekurzor syntetické kyseliny octové
-
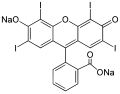
Erythrosin, potravinářské barvivo
-
Ioversol, organojodidová kontrastní látka pro rentgenová vyšetření
-
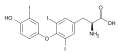
Trijodthyronin (T3), další hormon vytvářený štítnou žlázou
Biologický význam
[editovat | editovat zdroj]Pro lidské zdraví mají význam dva organojodidové hormony, vytvářené ve štítné žláze: thyroxin (T4) a trijodthyronin (T3).[9]
V mořských organismech, jako je například houba Plakortis simplex, obsahující plakohypaforiny, se nachází velká množství organojodidů .
Množství jodmethanu ročně vytvořeného v mořích, činností mikroorganismů na rýžových polích a spalováním biologického materiálu se odhaduje na 214 000 tun.[10] Jodmethan se v atmosféře oxiduje a vytváří se tak koloběh jodu.
Celkem bylo popsáno přes 3000 organojodidů.[11]
Způsoby tvorby vazeb C-I
[editovat | editovat zdroj]Z I2
[editovat | editovat zdroj]Organické sloučeniny jodu se připravují mnoha způsoby, závisejícími na požadované míře a regiochemii jodace a vlastnostech prekurzorů. Přímá jodace I2 se provádí u nenasycených substrátů:
- RHC=CH2 + I2 → RHIC-CIH2
Touto reakcí se stanovuje jodové číslo, ukazující na míru nenasycenosti tuků a podobných látek.
Ze zdrojů I−
[editovat | editovat zdroj]Jodidový anion je dobrým nukleofilem a může z molekul odstranit chloridové, tosylátové, bromidové i jiné odstupující skupiny, což se například využívá ve Finkelsteinových reakcích.
Alkoholy lze na příslušné jodidy přeměnit pomocí jodidu fosforitého, jako příklad může sloužit přeměna methanolu na jodmethan:[12]
- PI3 + 3 CH3OH → 3 CH3I + H3PO3
U alkoholů s objemnými substituenty se používá methiodid trifenylfosfitu.[13]
- [CH3(C6H5O)3P]+I− + ROH → RI + CH3(C6H5O)2PO + C6H5OH
Aryljodidy lze připravit z diazoniových solí reakcí s jodidem draselným:[14]
Ze zdrojů I+
[editovat | editovat zdroj]Na benzen lze navázat jod směsí jodu a kyseliny dusičné.[15] Jako zdroj I+ lze také použít chlorid jodný.
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Organoiodine compound na anglické Wikipedii.
- ↑ Alex G. Fallis, Pierre E. Tessier, "2-Iodoxybenzoic acid (IBX)1" Encyclopedia of Reagents for Organic Synthesis, 2003 John Wiley DOI:10.1002/047084289X.rn00221
- ↑ S. J. Blanksby; G. B. Ellison. Bond dissociation energies of organic molecules. Accounts of Chemical Research. 2003, s. 255–263. DOI 10.1021/ar020230d.
- ↑ LYDAY, Phyllis A.; KAIHO, Tatsuo. Iodine and Iodine Compounds. Příprava vydání Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA Dostupné online. ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a14_381.pub2. S. 1–13. (anglicky) DOI: 10.1002/14356007.a14_381.pub2.
- ↑ Allard, A.S. and A. H. Neilson 2003 Degradation and transformation of organic bromine and iodine compounds: comparison with their chlorinated analogues. The Handbook of Environmental Chemistry 3:1-74.
- ↑ McTamney, P.M. and S.E. Rokita 2010. A mammalian reductive deiodinase has broad power to dehalogenate chlorinated and brominated substrates. Journal of the American Chemical Society 131(40): 14212–14213
- ↑ Cupples, A. M., R. A. Sanford, and G. K. Sims. 2005. Dehalogenation of Bromoxynil (3,5-Dibromo-4-Hydroxybenzonitrile) and Ioxynil (3,5-Diiodino-4-Hydroxybenzonitrile) by Desulfitobacterium chlororespirans Applied and Environmental Microbiology 71(7):3741-3746.
- ↑ Ulrich Speck, Ute Hübner-Steiner "Radiopaque Media" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005 DOI:10.1002/14356007.a22_593
- ↑ "Key Lubrication Ingredient: Iodine Moves to Space Age", Schenectady Gazette, November 17, 1965
- ↑ G. W. Gribble. Naturally occurring organohalogen compounds - A comprehensive survey. Progress in the Chemistry of Organic Natural Products. 1996, s. 1–423. DOI 10.1021/np50088a001. PMID 8795309.
- ↑ N. Bell; L. HSU; D. J. JACOB; M. G. SCHULTZ; D. R. BLAKE; J. H. BUTLER; D. B. KING. Methyl iodide: Atmospheric budget and use as a tracer of marine convection in global models. Journal of Geophysical Research. 2002, s. 4340. Dostupné online. DOI 10.1029/2001JD001151. Bibcode 2002JGRD..107.4340B.
- ↑ V. M. Dembitsky; G. A. Tolstikov. Naturally occurring organohalogen compounds - A comprehensive survey.Chybí název periodika! 2003.
- ↑ KING, C. S.; HARTMAN, W. W. Methyl Iodide. Org. Synth.. 1933, s. 60. DOI 10.15227/orgsyn.013.0060.
- ↑ H. N. Rydon. Alkyl Iodides: Neopentyl Iodide and Iodocyclohexane. Organic Syntheses. 1971, s. 44. DOI 10.15227/orgsyn.051.0044.
- ↑ H. J. Lucas; E. R. Kennedy. Iodobenzene. Organic Syntheses. 1939, s. 55. DOI 10.15227/orgsyn.019.0055.
- ↑ F. B. DAINS; R. Q. BREWSTER. Iodobenzene. Org. Synth.. 1929, s. 46. DOI 10.15227/orgsyn.009.0046.
Související články
[editovat | editovat zdroj]Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu Organojodidy na Wikimedia Commons
Obrázky, zvuky či videa k tématu Organojodidy na Wikimedia Commons