STX1A
La Sintaxina-1A és una proteïna que en els éssers humans és codificada pel gen STX1A.[5]
Funció
[modifica]Les vesícules sinàptiques emmagatzemen neurotransmissors que són alliberats durant l'exocitosi regulada per calci. L'especificitat d'alliberament del neurotransmissor requereix la localització tant de les vesícules sinàptiques com dels canal de calci a la zona activa presinàptica. Les sintaxines funcionen en aquest procés de fusió de la vesícula.
La sintaxina-1A és un membre de la superfamília de les sintaxines. Les sintaxines són proteïnes específiques del sistema nerviós implicades en la unió de les vesícules sinàptiques a la membrana plasmàtica presinàptica. Les sintaxines tenen un sol domini transmembrana C-terminal, un SNARE (proteïna d'unió NSF soluble), conegut com a H3, i un domini regulador N-terminal (Habc). Les sintaxines s'uneixen a una sinaptotagmina de forma dependent del calci i interactuen amb canals de calci i potassi dependents de tensió a través del domini C3 del terminal H3. Syntaxin-1A és una proteïna clau en la regulació del canal iònic i l'exocitosi sinàptica.[6]
Importància clínica
[modifica]Les sintaxines serveixen com a substrat per a la neurotoxina botulínica de tipus C, una metal·loproteasa que bloca l'exocitosi i té una alta afinitat per un complex molecular que inclou el receptor alfa-latrotoxina, el qual produeix una exocitosi explosiva.[7]
El nivell d'expressió de la proteïna STX1Un és directament correlacionat amb la intel·ligència dins la síndrome de Williams.[8]
Mapa interactiu de la ruta
[modifica]|
|
Aquest article o secció necessita millorar una traducció deficient. Caldria traduir els termes de la imatge amb el codi |
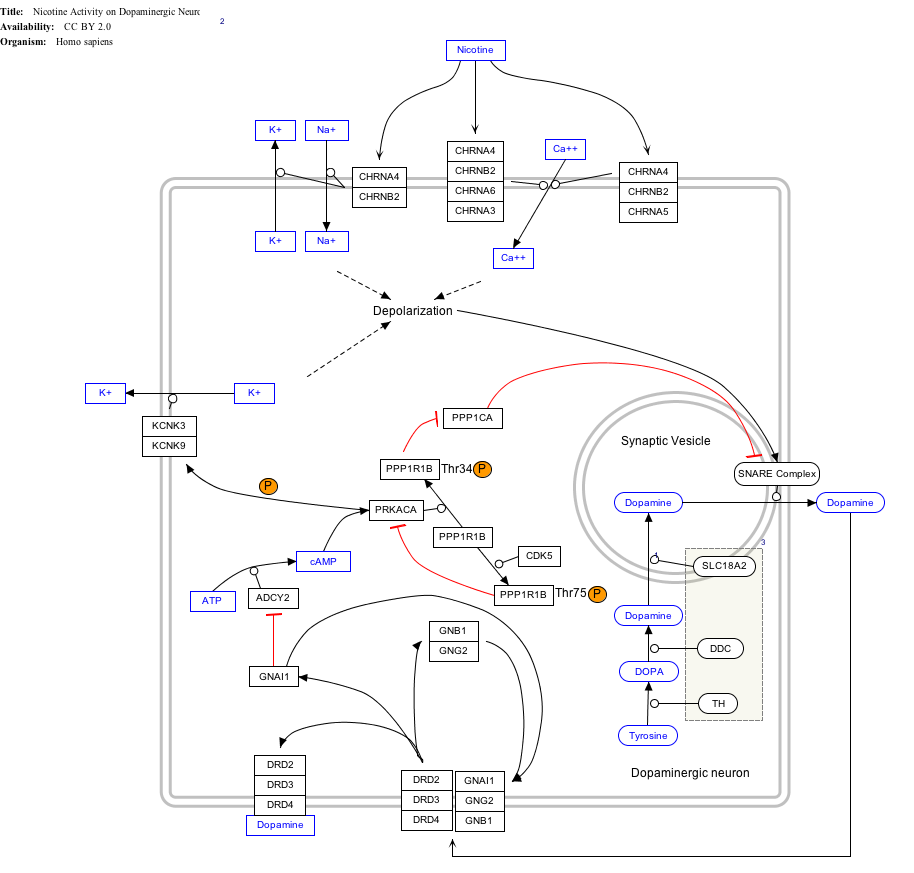
Interaccions
[modifica]Ha estat demostrat que STX1A interacciona amb:
Referències
[modifica]- ↑ 1,0 1,1 1,2 GRCh38: Ensembl release 89: ENSG00000106089 - Ensembl, May 2017
- ↑ 2,0 2,1 2,2 GRCm38: Ensembl release 89: ENSMUSG00000007207 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Syntaxin: a synaptic protein implicated in docking of synaptic vesicles at presynaptic active zones». Science. DOI: 10.1126/science.1321498. PMID: 1321498.
- ↑ «Entrez Gene: STX1A syntaxin 1A (brain)».
- ↑ «Cloning and sequence analysis of a cDNA encoding human syntaxin 1A, a polypeptide essential for exocytosis». Gene. DOI: 10.1016/0378-1119(95)00152-V. PMID: 7622072.
- ↑ «Intelligence in Williams Syndrome Is Related to STX1A, Which Encodes a Component of the Presynaptic SNARE Complex». PLoS ONE. DOI: 10.1371/journal.pone.0010292. PMC: 2858212. PMID: 20422020.
- ↑ 9,0 9,1 9,2 9,3 «A conformational switch in syntaxin during exocytosis: role of munc18». The EMBO Journal, 18, 16, 8-1999, pàg. 4372–82. DOI: 10.1093/emboj/18.16.4372. PMC: 1171512. PMID: 10449403.
- ↑ 10,0 10,1 10,2 «Three-dimensional structure of the complexin/SNARE complex». Neuron, 33, 3, 1-2002, pàg. 397–409. DOI: 10.1016/S0896-6273(02)00583-4. PMID: 11832227.
- ↑ «Action of complexin on SNARE complex». The Journal of Biological Chemistry, 277, 44, 11-2002, pàg. 41652–6. DOI: 10.1074/jbc.M205044200. PMID: 12200427.
- ↑ «Regulation of CFTR chloride channels by syntaxin and Munc18 isoforms». Nature, 390, 6657, 11-1997, pàg. 302–5. DOI: 10.1038/36882. PMID: 9384384.
- ↑ «CFTR chloride channels are regulated by a SNAP-23/syntaxin 1A complex». Proceedings of the National Academy of Sciences of the United States of America, 99, 19, 9-2002, pàg. 12477–82. DOI: 10.1073/pnas.192203899. PMC: 129470. PMID: 12209004.
- ↑ 14,0 14,1 14,2 14,3 «Complexins: cytosolic proteins that regulate SNAP receptor function». Cell, 83, 1, 10-1995, pàg. 111–9. DOI: 10.1016/0092-8674(95)90239-2. PMID: 7553862.
- ↑ «The N-ethylmaleimide-sensitive fusion protein and alpha-SNAP induce a conformational change in syntaxin». The Journal of Biological Chemistry, 270, 28, 7-1995, pàg. 16955–61. DOI: 10.1074/jbc.270.28.16955. PMID: 7622514.
- ↑ «Staring, a novel E3 ubiquitin-protein ligase that targets syntaxin 1 for degradation». The Journal of Biological Chemistry, 277, 38, 9-2002, pàg. 35071–9. DOI: 10.1074/jbc.M203300200. PMID: 12121982.
- ↑ «ENaC subunit-subunit interactions and inhibition by syntaxin 1A». American Journal of Physiology. Renal Physiology, 286, 6, 6-2004, pàg. F1100-6. DOI: 10.1152/ajprenal.00344.2003. PMID: 14996668.
- ↑ «Protein kinase C regulates the interaction between a GABA transporter and syntaxin 1A». The Journal of Neuroscience, 18, 16, 8-1998, pàg. 6103–12. PMID: 9698305.
- ↑ «Substrates regulate gamma-aminobutyric acid transporters in a syntaxin 1A-dependent manner». Proceedings of the National Academy of Sciences of the United States of America, 99, 8, 4-2002, pàg. 5686–91. DOI: 10.1073/pnas.082712899. PMC: 122832. PMID: 11960023.
- ↑ «Transport rates of GABA transporters: regulation by the N-terminal domain and syntaxin 1A». Nature Neuroscience, 3, 10, 10-2000, pàg. 998–1003. DOI: 10.1038/79939. PMID: 11017172.
- ↑ «A human protein-protein interaction network: a resource for annotating the proteome». Cell, 122, 6, 9-2005, pàg. 957–68. DOI: 10.1016/j.cell.2005.08.029. PMID: 16169070.
- ↑ 22,0 22,1 «A novel ubiquitous form of Munc-18 interacts with multiple syntaxins. Use of the yeast two-hybrid system to study interactions between proteins involved in membrane traffic». The Journal of Biological Chemistry, 270, 22, 6-1995, pàg. 13022–8. DOI: 10.1074/jbc.270.22.13022. PMID: 7768895.
- ↑ «Membrane localization and biological activity of SNAP-25 cysteine mutants in insulin-secreting cells». Journal of Cell Science, 113 (Pt 18), 18, 9-2000, pàg. 3197–205. PMID: 10954418.
- ↑ «Snapin: a SNARE-associated protein implicated in synaptic transmission». Nature Neuroscience, 2, 2, 2-1999, pàg. 119–24. DOI: 10.1038/5673. PMID: 10195194.
- ↑ «Spring, a novel RING finger protein that regulates synaptic vesicle exocytosis». The Journal of Biological Chemistry, 276, 44, 11-2001, pàg. 40824–33. DOI: 10.1074/jbc.M106141200. PMID: 11524423.
- ↑ 26,0 26,1 «Identification of a novel syntaxin- and synaptobrevin/VAMP-binding protein, SNAP-23, expressed in non-neuronal tissues». The Journal of Biological Chemistry, 271, 23, 6-1996, pàg. 13300–3. DOI: 10.1074/jbc.271.23.13300. PMID: 8663154.
- ↑ «SNAP-25, a t-SNARE which binds to both syntaxin and synaptobrevin via domains that may form coiled coils». The Journal of Biological Chemistry, 269, 44, 11-1994, pàg. 27427–32. PMID: 7961655.
- ↑ 28,0 28,1 «Three novel proteins of the syntaxin/SNAP-25 family». The Journal of Biological Chemistry, 273, 51, 12-1998, pàg. 34171–9. DOI: 10.1074/jbc.273.51.34171. PMID: 9852078.
- ↑ «Intracellular localisation of SNARE proteins in rat parotid acinar cells: SNARE complexes on the apical plasma membrane». Archives of Oral Biology, 48, 8, 8-2003, pàg. 597–604. DOI: 10.1016/S0003-9969(03)00116-X. PMID: 12828989.
- ↑ «Syntaxin isoform specificity in the regulation of renal H+-ATPase exocytosis». The Journal of Biological Chemistry, 278, 22, 5-2003, pàg. 19791–7. DOI: 10.1074/jbc.M212250200. PMID: 12651853.
- ↑ «Inhibition of the binding of SNAP-23 to syntaxin 4 by Munc18c». Biochemical and Biophysical Research Communications, 234, 1, 5-1997, pàg. 257–62. DOI: 10.1006/bbrc.1997.6560. PMID: 9168999.
- ↑ «Co-purification and localization of Munc18-1 (p67) and Cdk5 with neuronal cytoskeletal proteins». Neurochemistry International, 44, 1, 1-2004, pàg. 35–44. DOI: 10.1016/S0197-0186(03)00099-8. PMID: 12963086.
- ↑ 33,0 33,1 «Munc 18a binding to syntaxin 1A and 1B isoforms defines its localization at the plasma membrane and blocks SNARE assembly in a three-hybrid system assay». Molecular and Cellular Neurosciences, 20, 2, 6-2002, pàg. 169–80. DOI: 10.1006/mcne.2002.1122. PMID: 12093152.
- ↑ «Tomosyn interacts with the t-SNAREs syntaxin4 and SNAP23 and plays a role in insulin-stimulated GLUT4 translocation». The Journal of Biological Chemistry, 278, 37, 9-2003, pàg. 35093–101. DOI: 10.1074/jbc.M304261200. PMID: 12832401.
- ↑ «Tomosyn: a syntaxin-1-binding protein that forms a novel complex in the neurotransmitter release process». Neuron, 20, 5, 5-1998, pàg. 905–15. DOI: 10.1016/S0896-6273(00)80472-9. PMID: 9620695.
- ↑ «Synaptotagmin-syntaxin interaction: the C2 domain as a Ca2+-dependent electrostatic switch». Neuron, 18, 1, 1-1997, pàg. 133–42. DOI: 10.1016/S0896-6273(01)80052-0. PMID: 9010211.
- ↑ «Functional and biochemical analysis of the C2 domains of synaptotagmin IV». Molecular Biology of the Cell, 10, 7, 7-1999, pàg. 2285–95. DOI: 10.1091/mbc.10.7.2285. PMC: 25443. PMID: 10397765.
- ↑ «Direct interaction of the rat unc-13 homologue Munc13-1 with the N terminus of syntaxin». The Journal of Biological Chemistry, 272, 4, 1-1997, pàg. 2520–6. DOI: 10.1074/jbc.272.4.2520. PMID: 8999968.
- ↑ «A stable interaction between syntaxin 1a and synaptobrevin 2 mediated by their transmembrane domains». FEBS Letters, 446, 1, 3-1999, pàg. 40–4. DOI: 10.1016/S0014-5793(99)00028-9. PMID: 10100611.
- ↑ «Effect of mutations in vesicle-associated membrane protein (VAMP) on the assembly of multimeric protein complexes». The Journal of Neuroscience, 17, 5, 3-1997, pàg. 1596–603. PMID: 9030619.
- ↑ «Localization of cellubrevin-related peptide, endobrevin, in the early endosome in pancreatic beta cells and its physiological function in exo-endocytosis of secretory granules». Journal of Cell Science, 114, Pt 1, 1-2001, pàg. 219–227. PMID: 11112705.






