Reacció orgànica
Les reaccions orgàniques són reaccions químiques que es donen entre compostos orgànics. La majoria de reaccions a nivell dels éssers vius són d’aquest tipus. També la producció de molts productes químics artificials com drogues, plàstics, additius alimentaris... depenen de reaccions orgàniques. Les reaccions orgàniques més antigues són les de combustió i saponificació de greixos. La química orgànica moderna va començar amb la síntesi de Wöhler el 1828. Els Premis Nobel de Química han reconegut en diverses ocasions als inventors de noves reaccions orgàniques com la reacció de Grignard el 1912, la reacció de Diels-Alder el 1950, la reacció de Wittig el 1979 i la metàtesi d’olefina el 2005.
Compostos orgànics
[modifica]Anomenem compostos orgànics a aquells que contenen carboni en la seva estructura. En són exemples tots els hidrocarburs, proteïnes, àcids nuclèics... Tot i això, hi ha una sèrie de compostos que, tot i contenir carboni, per raons històriques es consideren compostos inorgànics: els al·lòtrops de carboni, els cianurs, els carbonats i els òxids simples de carboni.
El carboni té unes característiques especials que en el seu conjunt el fan un element únic, de tal forma que constitueix la base de tots els compostos orgànics. Aquestes característiques són:
- Tetravalència: s²p², és a dir, s px py pz. La seva variació d'entalpia és de –400 kJ/mol (es desprenen 830 kJ/mol al formar 2 enllaços C–H) fet que ofereix la possibilitat d’unir-se a si mateix formant cadenes. Aquesta capacitat de formar cadenes és essencial per la formació de compostos orgànics.
- Electronegativitat intermèdia, fet que li permet formar enllaços covalents tant amb metalls com amb no metalls.
- És un àtom petit, cosa que possibilita la formació d’enllaços dobles i triples, perquè permet que els altres elements s’aproximin el suficient com per poder formar l'enllaç.
El silici pot tenir unes propietats semblants a les del carboni no és suficientment petit com per formar dobles i triples enllaços i no pot formar cadenes com ho fa el carboni.
Reactivitat dels compostos orgànics
[modifica]La reactivitat que presenten els compostos orgànics es deu bàsicament a la presència de grups funcionals, ja sigui a causa de l'elevada densitat electrònica (dobles i triples enllaços) o de la fracció de càrrega positiva en l’àtom de carboni (degut als enllaços que realitza amb altres elements). Per poder entendre la causa i funcionament d’una reacció determinada, és a dir, el seu mecanisme, s’han de comprendre els desplaçaments electrònics, els intermedis de reacció i les ruptures d’enllaços, els diferents tipus de reactius i la selectivitat de productes.
Ruptura d’enllaços i intermedis de reacció
[modifica]Els enllaços dels compostos orgànics són enllaços covalents d’alta energia. Hi ha dues formes de trencament d’aquests enllaços:
- Homolítica: l'enllaç covalent es trenca de forma simètrica deixant un electró a cada àtom formant així radicals lliures. Aquest tipus de trencament necessita una elevada aportació energètica, per això s’acostuma a donar en presència de llum ultraviolada (raó per la qual aquesta pot ser perjudicial per als éssers vius).
- A−B → A• + B•
- Heterolítica: l'enllaç es trenca de forma asimètrica de manera que un dels àtoms constituents de l'enllaç es queda amb els dos electrons: l’àtom més electronegatiu es queda carregat negativament i l’àtom menys electronegatiu queda amb càrrega positiva. Aquesta forma de trencament amb la que obtenim dos tipus d’ions (carbanions i carbocations) és la més habitual.
Els intermedis de reacció són espècies intermèdies que es formen a mesura que la reacció avança dels reactius cap als productes. Aquests són menys estables que els reactius i que els productes i tenen una vida mitjana molt curta en la reacció. Tot i això hi ha una sòlida evidència experimental de la seva existència. Els componen el conjunt de radicals lliures, carbanions, carbens i carbocations que es van formant i desapareixent durant la reacció.
Els carbocations són espècies amb una hibridació sp², una estructura plana i angles d’enllaç de 120o. Experimentalment s’ha observat que l'estabilitat dels carbocations augmenta amb el seu grau de substitució (de menys a més estable: primari, secundari, terciari, al·lil, benzil...). Tenint en compte aquest ordre podem concloure que els grups metil i en general qualsevol cadena alifàtica, provoquen un augment de l'estabilitat del carbocatió. Això es deu a l'efecte inductiu que els grups metil i les cadenes alifàtiques fan sobre el centre carbocatiònic. Els carbocations presenten una característica important que és la transposició, és a dir, que si tenim un intermedi de naturalesa carbocatiònica i té la possibilitat de passar a un altre de més estable, ho farà mitjançant una transposició (migració d’un àtom d’hidrogen o reste alquil amb el seu parell d’electrons des d’un carboni fins al carboni veí amb càrrega positiva orientada cap al carboni, de forma que la càrrega queda en el carboni d’on procedien els àtoms que han emigrat).
Els carbanions també presenten un carboni trivalent (amb tres enllaços) però, com porten una càrrega negativa, al voltant de l’àtom de carboni hi ha vuit electrons que corresponen a tres enllaços i a un parell solitari. El carboni del carbanió presenta una hibridació sp3, per tant té un estructura tetraèdrica on una posició està ocupada pel parell d’electrons lliures. Com hem vist anteriorment, el grup metil i els grups alquils cedeixen densitat electrònica per efecte inductiu i provoquen una elevada concentració de densitat electrònica al carboni aniònic. Aquest fet provoca un augment de la inestabilitat dels carbanions, per tant l’ordre d’estabilitat dels carbanions és l’oposat al dels carbocations. D’altra banda s’observa que l'estabilitat disminueix al disminuir el caràcter s de l’orbital híbrid, ja que els carbanions procedents d’alquins són més estables que els procedent d’alquens, i aquests més estables que els procedents d’alcans. Aquest efecte sobre l'estabilitat ve donat per la naturalesa de l’orbital que ocupen el parell d’electrons lliures: generalment els electrons dels orbitals s estan més a prop del nucli que els electrons dels orbitals p, i com les forces d’atracció electroestàtica són més intenses com més a prop del nucli, els electrons d’orbitals s tindran menys energia i més estabilitat que els d’orbitals p.
Els radicals lliures presenten una hibridació sp² en l’àtom de carboni amb deficiència d’electrons perquè a l’orbital p hi ha l'electró desaparellat. Són espècies planes i deficients en electrons perquè els falta l’octet al voltant de l’àtom de carboni. Aquests s’estabilitzen per l'efecte inductiu electró-dador que fan les cadenes alquíliques, de manera que un radical primari serà menys estable que un secundari i aquest menys estable que un terciari.
Els carbens són intermedis de reacció sense càrrega i que contenen un àtom de carboni divalent. Tenen una hibridació sp² en el carboni cosa que explica la seva estructura electrònica i la seva geometria trigonal. En aquest cas l’orbital p està buit i el parell d’electrons lliure es troba en un dels orbitals híbrids sp². El carbè més senzill és el metilè CH₂.
Desplaçaments electrònics
[modifica]Pel que fa als desplaçaments electrònics en trobem de dos tipus:
- D’efecte inductiu: desplaçament parcial del parell d’electrons d’un àtom senzill cap a l’àtom més electronegatiu provocant fraccions de càrrega. Si prenem com a referència l’àtom d’hidrogen, que per conveni es considera que no provoca efecte inductiu (ja que l’aportació del seu parell electrònic en unir-se amb el carboni és molt lleu) podem classificar el grups en funció de si aporten o agafen electrons. Els grups que n’aporten són –CH₃, –CH₂–CH₃, –CH(CH₃)₂, –C(CH₃)₃, –COO–, –O–... mentre que els grups que n’agafen són –NO₂, – COOH, – X (halogen), –OH... en les cadenes alifàtiques l'efecte inductiu es pot explicar com una donació de la densitat electrònica dels enllaços sigma al centre catiònic, fet que provoca una estabilització del sistema al disminuir el dèficit de densitat electrònica del carboni sp². Per exemple, en el carbocatió terciari hi ha tres grups alquil que cedeixen electrons que ajuden a deslocalitzar la càrrega positiva de l’àtom de carboni de tal forma que s'estabilitza el carbocatió. Si el carbocatió és secundari com la dispersió de càrrega és menor, aquest no és tant estable.
- D’efecte mesòmer o ressonància: desplaçament del parell d’electrons del doble enllaç cap a un dels àtoms per la presència de parells d’electrons propers. Aquest efecte es produeix quan hi ha enllaços múltiples i la possibilitat que els electrons es deslocalitzin, és a dir, un àtom electronegatiu amb la possibilitat de tenir parelles d’electrons sense compartir. Com més elevat sigui el nombre de formes ressonants més estabilitat té el compost. Igual que en l'efecte inductiu trobem compostos que cedeixen els parells d’electrons lliures de l’àtom unit al carboni i compostos en els quals l’àtom unit al carboni agafa un parell d’electrons del doble o triple enllaç. Quan els àtoms cedeixen parells d’electrons es forma un doble enllaç. Alguns dels grups que cedeixen parells d’electrons són -NH₂, -NH-R, -OH, -O-CH₃, -X (alògen).... i alguns dels que n’agafen són –CHO, –NO, –CN, –CO–CH₃, –COOH...
- Aquest efecte també pot estabilitzar carbocations. Si tenim en compte la contribució de les estructures ressonants a la deslocalització de la càrrega positiva podem entendre perquè el benzil és més estable que una carbocatió primari.
Tipus de reactius
[modifica]En les reaccions orgàniques trobem tres tipus de reactius: radicals lliures, reactius nucleòfils i reactius electròfils.
- Els radicals lliures són espècies químiques que tenen àtoms amb electrons desaparellats.
- Els reactius nucleòfils són aquells que tenen un o més parells d’electrons lliures i ataquen a parts dels compostos amb una deficiència d’electrons. Són les anomenades bases de Lewis. Alguns exemples són: HO-, RO-, N≡C-, X-, ROH, R₃N, H₂O...
- Els reactius electròfils són aquells que tenen els orbitals més externs buits i ataquen a zones d’alta densitat electrònica. Són els anomenats àcids de Lewis. Algun exemples són: H+, X+, NO₂+, BF₃, AlCl₃...
El que diferencia els conceptes àcid/base de Lewis i nucleòfil/electròfil són termes cinètics i termodinàmics. L'acidesa i la basicitat són conceptes termodinàmics, que es refereixen a l'equilibri entre un dador d’electrons i un àcid. Els conceptes nucleòfil i electròfil són de naturalesa cinètica: un bon nucleòfil és aquell que reacciona de forma ràpida amb electròfils.
Selectivitat dels productes
[modifica]- Regioselectivitat: es diu que una reacció és regioselectiva quan entre diversos productes possibles sol se n’obté un d’ells.
- Estereoselectivitat: es diu que una reacció és estereoselectiva quan entre diversos estereoisòmers se n’obté preferentment un d’ells.
- Estereoespecificitat: una reacció és estereoespecífica quan transcorre de diferent manera en funció de l'estereoisòmer utilitzat.
Classificació
[modifica]Hi ha una llarga tradició de posar a les noves reaccions orgàniques el nom del seu inventor o inventors; existeix una llista que conté el nom de totes les reaccions orgàniques i es calcula que aproximadament n’existeixen unes 1000. En aquestes reaccions s’utilitzen abreviacions dels noms o sigles si són diversos inventors o simplement el nom de l'inventor si n'és un de sol. Les reaccions orgàniques es poden classificar segons diferents criteris. Aquests criteris són independents uns dels altres, és a dir, una mateixa reacció es pot classificar de moltes maneres.
Segons la forma d’activació de les molècules
[modifica]- Tèrmica
- Fotoquímica
- Electroquímica
Segons l'intercanvi energètic amb l'entorn
[modifica]- Exotèrmica: reacció que va acompanyada d’un despreniment d'energia en forma de calor. Com la calor es desprèn la variació d’entalpia de la reacció és negativa. La fórmula general d’una reacció exotèrmica és:
- Reactius → Productes + Energia
- Endotèrmica: reacció que va acompanyada d’una absorció d’energia en forma de calor. Com la calor s’absorbeix el nivell energètic dels productes és més elevat que el dels reactius i per tant la variació d’entalpia és positiva. La fórmula general d’una reacció endotèrmica és:
- Reactius + Energia → Productes
Segons la forma de trencament dels enllaços
[modifica]- Reaccions de col·ligació: reaccions que es produeixen quan els radicals lliures s’uneixen formant un enllaç covalent (procés invers a l’homòlisi).
- Reaccions de coordinació: reaccions en les quals s’enllaça un anió o espècie amb un excés de densitat electrònica i un catió o espècie amb dèficit electrònic (procés invers a l’heteròlisi).
Segons el trencament i formació d'enllaços
[modifica]- Reaccions no concertades: reaccions en les quals el trencament i formació d’enllaços es produeix en etapes diferenciades. És en aquest tipus de reaccions en les quals es formen espècies intermèdies més o menys estables.
- Reaccions concertades: reaccions en les quals el trencament i formació d’enllaços es produeix simultàniament.
Segons la naturalesa dels reactius
[modifica]- Nucleòfils
- Electròfils
Els electròfils són els reactius que acostumen a formar enllaços amb centres electrodensos (normalment centres insaturats o amb parells d’electrons no compartits), mentre que els nucleòfils tendeixen a reaccionar amb el carboni electrònicament deficitari (enllaçat a àtoms electronegatius). El que els dona aquest caràcter nucleòfil és el fet de tenir àtoms de carboni, nitrogen, oxigen o sofre amb parells d’electrons sense compartir. Segons la classificació d’àcids i bases de Lewis podem considerar àcids als electròfils i bases als nucleòfils.
Segons si els reactius s’oxiden o es redueixen
[modifica]Aquestes reaccions formalment són d’addició, eliminació o substitució.
- Oxidació: reacció en què un àtom o ió perd un o més electrons augmentant el seu estat d’oxidació. Aquest actua com un agent reductor. Fe₂+ → Fe₃+ + e-
- Reducció: reacció en que un àtom o ió guanya un o més electrons disminuint el seu estat d’oxidació. Aquest actua com un agent oxidant. Fe₂++ H₂ → 2Fe+ + 2H+
- Redox: també s’anomenen reaccions d’oxidoreducció. Són aquelles que es realitzen per transferència d’electrons des d’un dador electrònic (l’agent reductor) a un acceptador (agent oxidant). En algunes reaccions redox la transferència d’un o més electrons es realitza mitjançant la transferència d'hidrògens; aleshores la deshidrogenació és equivalent a l’oxidació. Els agents oxidant i reductor actuen com a parell redox conjugat (integrat per un dador electrònic i un acceptor conjugat) de la mateixa manera que els àcids i les bases de Brønsted actuen com a parell conjugat àcid-base. La tendència d’un agent reductor a perdre electrons (o la d’un agent oxidant a guanyar-ne) ve donada pel seu potencial d’oxidoreducció estàndard.
- En les reaccions orgàniques aquesta transferència d’electrons no acostuma a ser completa i la reacció redox es produeix com un canvi en els enllaços covalents entre àtoms de diferent electronegativitat. Per calcular l'estat d’oxidació en les molècules orgàniques s’admet que el carboni elemental es troba en un estat d’oxidació zero. La formació d’un enllaç entre el carboni i un àtom més electronegatiu és un procés d’oxidació i la formació d’un enllaç entre el carboni i un àtom menys electronegatiu és un procés de reducció, donat que en ells es produeix un augment o disminució de la densitat electrònica sobre l’àtom de carboni.
- En la cloració del metanol per exemple, l’àtom de carboni experimenta un cessió parcial de densitat electrònica i els àtoms de clor un guany parcial de densitat electrònica, els àtoms de carboni s’oxiden i els de clor es redueixen degut a la major electronegativitat del clor respecte al carboni i l’hidrogen. Els àtoms més electronegatius que el carboni atrauen els electrons d’enllaç cap a ells mateixos quedant amb nombre d’oxidació negatiu. D’aquesta manera podem dir que el clor ha actuat com a oxidant i el metanol com a reductor.
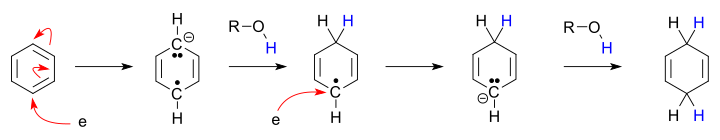
- En aquesta imatge de la reacció de Birch s'observa clarament el mecanisme del procés:
- Les reaccions d’oxidació reducció més típiques són:
- Oxidació d’alquens: els alquens s’oxiden formant dialcohols, però si no es prenen precaucions l’oxidació pot ser més profunda i acabar formant aldehids i/o cetones.
- Ozonòlisis: reacció específica del doble enllaç que consisteix en el trencament del mateix partint la cadena en dos i formant àcids carboxílics o cetones. Si aquesta mateixa reacció es fa en un medi reductor es podria obtenir aldehids en lloc d’àcids carboxílics.

- Oxidació d’alcohols: els alcohols s’oxiden per l’acció del KMnO₄ o del K₂Cr₂O₇ a aldehids o cetones depenent de si es tracta d’un alcohol primari o secundari, respectivament. Els alcohols terciaris, en canvi, son bastant resistents a l’oxidació.

- Oxidació i reducció d’aldehids i cetones: els aldehids són substàncies molt fràgils i reductores i s’oxiden amb facilitat a àcids, tot i que també poden transformar-se en alcohols primaris i fins i tot hidrocarburs en presència d’un ambient reductor fort, depenent del catalitzador utilitzat. En canvi, les cetones sofreixen reaccions de reducció similars als aldehids, però es resisteixen a oxidar-se.
- Combustió: reacció en la qual es combina una substància combustible amb un element oxidant (generalment l’oxigen) desprenent calor i donant lloc productes oxidats (molt sovint diòxid de carboni i aigua). En la reacció següent es pot observar la combustió d’un hidrocarbur.
- C10H₈+ 12O₂ → 10CO₂ + 4H₂O
Segons el canvi estructural dels components
[modifica]- Substitució: reacció en la qual un àtom o un grup d’àtoms és desplaçat o substituït per un altre àtom o grup d’àtoms. La fórmula general és: A + BC → AC + B
- En podem distingir diferents tipus:
- Reaccions de substitució nucleòfila: reacció en la qual un nucleòfil substitueix un àtom (o grup d’àtoms) d’un compost que estava en una posició electròfila, que normalment és un carboni electròfil. Algunes d’aquestes reaccions més típiques són:
- Reduccions orgàniques amb hidrurs: R-X → R-H
- Reaccions d’hidròlisi: R-Br + OH- → R-OH + Br- o R-Br + H₂O → R-OH + HBr
- Síntesi d’èters : R-Br + −OR' → R-OR' + Br-
- Reaccions de substitució electròfila: el reactiu és de tipus electrofílic i atacarà la zona del substrat amb major densitat de càrrega negativa. Destaquem tres tipus de substitució electròfila: nitració, halogenació i alquilació. N'és un exemple la substitució electròfila que es dona en els compostos aromàtics:

- Substitució radicàlica: reacció en la qual el reactiu és un radical i el trencament de l'enllaç és homolític, és a dir, cada fragment es queda amb un electró de l'enllaç. La reacció es dona en cadena i és molt difícil de controlar; transcorre en tres etapes:
- Iniciació: formació d’un radical mitjançant una radicació.
- Propagació: es formen diferents radicals i compostos.
- Finalització: obtenció del producte final.
- Un exemple de substitució radicàlica on diferenciem les tres etapes és en el que reaccionen el metà i el clor:
- Iniciació: Cl : Cl → Cl• + Cl•
- Propagació: CH₄ + Cl• → CH₃• + HCl
- Finalització: CH₃• + Cl• → CH₃Cl
- Reaccions de doble Substitució: reacció en la qual els ions d’un compost s’intercanvien amb els d’una altre. En la següent reacció s’observa l’intercanvi dels ions H+ i Na+.
- HCl + NaOH → H₂O + NaCl
- Si tenim en compte els compostos que reaccionen destaquem dos tipus de substitucions:
- Reaccions de substitució en haloalcans: aquesta reacció es pot donar de diferents maneres: per mecanismes de dissociació heterolítica o per mecanismes concertats. Un exemple és la substitució del sodi per l’hidrogen en l’àcid clorhídric donant com a productes clorur de sodi i hidrogen. 2Na + 2HCl → 2NaCl + H₂
- Reaccions de substitució en hidrocarburs aromàtics: aquests hidrocarburs tendeixen a fer reaccions de substitució més que d’addició perquè d’aquesta manera es manté la ressonància del compost, és una estructura més favorable.
- Addició: reaccions en les quals els enllaços múltiples de molècules insaturades es transformen en enllaços senzills en afegir-hi espècies químiques. Poden ser reaccions d’addició a enllaços carboni-carboni dobles (C=C) o triples (C≡C), a grups carbonil (C=O) o a grups nitril (C≡N).
- Existeixen tres tipus principals d’addicions:
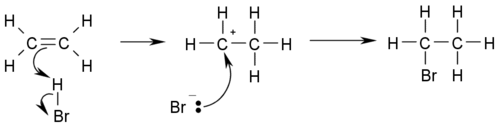
- Electròfila: el reactiu s’afegeix a un doble o triple enllaç poc polaritzat, com el que trobem entre àtoms de carboni. Normalment segueixen un mecanisme unimolecular i segueixen la regla de Markownikoff. Aquestes reaccions es donen en dues etapes, una de lenta i una de ràpida. En l'exemple podem distingir-les:
- CH₃–CH=CH₂ + HBr → CH₃–CHBr–CH₃ reacció directa
- CH₃–CH=CH₂ → CH₃–C+H–C–H₂ etapa lenta. El carboni secundari suporta millor la càrrega positiva que el carboni primari perquè està millor compensada per l'efecte +I de dos grups CH₃ i C–H₂ (seguint la regla de Markownikoff).
- CH₃–C+H–C–H₂ + HBr → CH₃–CHBr–CH₃ etapa ràpida
- Nucleòfila: es dona en substàncies orgàniques amb dobles enllaços fortament polaritzats, com per exemple l'enllaç C=O. Aquestes reaccions també es donen en dues etapes: la primera lenta i la segona ràpida.
- Nu- + RR'C=O → NuRR'C-O- (Atac nucleófil lent)
- NuRR'C-O- + H+ → NuRR'C-OH (Protonació ràpida)
- Radicàlica: és poc freqüent i es produeix en presència de peròxids. No segueixen la regla de Markownikoff.
- Segons els reactius podem distingir diferents tipus d’adicions:
- reaccions d’adició en alquens i alquins: aquestes reaccions s’anomenen d’adició electròfila perquè comencen per l’atac de l'electròfil a l'enllaç múltiple. Aquesta etapa lenta justifica que l’adició d’electròfils catalitzi l’adició d’àcids dèbils. En el cas que l’alquè no sigui simètric la reacció podrà produir dos isòmers diferents, un amb cada ió: el més abundant serà el que sigui més estable.
- Per la majoria d’adicions a enllaços múltiples podem deduir quin serà l’isòmer més abundant amb la rebla de Markovnikoff: “La part positiva del reactiu s’uneix al carboni més hidrogenat”. Aquesta regla només ens és útil en el cas que no hi hagin peròxids ja que si hi han peròxid l’adició no es dona electrofílicament sinó que segueix un mecanisme més complex on intervenen els radicals lliures.
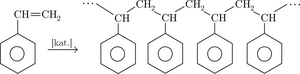
- reaccions de polimerització: en alquens aquesta reacció la podem considerar com una reacció d’autoaddició.
- reaccions de cicloaddició: un exemple típic són les reaccions de Diels-Alder.
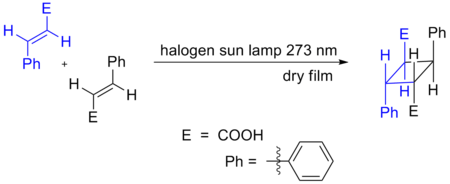
- reaccions d’adició sobre grups carbonil: l'electròfil s’uneix a l’oxigen i el nucleòtid al carboni.
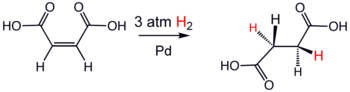
- reaccions d’hidrogenació: es dona una saturació del doble enllaç amb hidrogen. Aquesta reacció necessita un catalitzador:
- Eliminació: en aquestes es dona el procés invers a l’addició. Consisteixen en una pèrdua d’àtoms o grups d’àtoms en la formació d’enllaços múltiples o anells. Normalment es necessita alguna substància o condició que canviï el sentit espontani de la reacció. Aquestes reaccions segueixen la regla Saytzeff: “En les reaccions d’eliminació, l’hidrogen surt del carboni adjacent al grup funcional que té menys hidrògens”.
Destaquem dos tipus de reaccions d'eliminació:
- Deshidrogenació de halogenurs d’alquil: és una reacció que té lloc en medi bàsic i es dona en dues etapes: la primera lenta i la segona ràpida. Exemple:
- CH₃–CH₂–CHBr–CH₃ + Na+ → CH₃–CH₂–C+H–CH₃ + NaBr (lenta)
- CH₃–CH₂–C+H–CH₃ + OH- → CH₃–CH=CH–CH₃ + CH₃–CH₂–CH=CH₂(81%) + H₂O(19%) (ràpida)
- Deshidratació d’alcohols: es dona en medi àcid i en tres etapes.
- Protonació
- Formació del carbocatió
- Formació de l’alquè
- Transposició: reaccions en les quals alguna o algunes de les reaccions senzilles esmentades van acompanyades d’un canvi en la constitució dels àtoms fonamentals (carboni, nitrogen, oxigen, sofre…), que origina una successió d’enllaços de la cadena diferent a la de partida, és a dir, una molècula amb estructura diferent.
Altres reaccions orgàniques
[modifica]- Reaccions de síntesi: reacció en que elements o compostos senzills s’uneixen per formar un compost més complex. Un exemple de reacció de síntesi és la formació de l’aigua en la qual dos hidrògens s’uneixen a un oxigen donant lloc a una molècula d’aigua.
- 2H₂+O₂ → 2H₂O
- Descomposició: reacció en que un compost es fragmenta en elements o compostos més senzills. Un exemple és la descomposició de l’òxid de ferro (II) en oxigen i ferro.
- FeO₂ → Fe+O₂
- Condensació: reacció en que s’uneixen dues molècules orgàniques amb la pèrdua intramolecular d’una molècula més petita. D’aquestes reaccions destaquem dos exemples: la formació d’amides a partir d‘àcids més amines i la formació d’esters a partir d’àcids més alcohols. En ambdues reaccions es perd una molècula d’aigua de forma intermolecular.
- CH₃ – CHO + NH₂ – OH → CH₃ – CH = N – OH + H₂O
- Saponificació: també anomenada hidròlisi bàsica. Reacció que es dona entre un àcid gras o un lípid saponificable portador de residus d’àcids grassos i una base o àlcali en la que s’obté com a principal producte la sal de l’àcid i de la base. Aquestos compostos són amfipàtics, és a dir, tenen una part polar i una apolar, de forma que poden interaccionar amb substàncies de diferents propietats. Uns exemples de saponificació són els següents:
- Greix + soda càustica → sabó + glicerina
- Esterificació: també anomenada hidròlisi àcida. Reacció química entre un àcid carboxílic i un alcohol que dona com a producte un ester. Es poden formar esters de pràcticament tots els oxoàcids inorgànics. És una reacció reversible en la qual es desprèn aigua.
- CH₃ – COOH + CH₃ – CH₂ – OH → CH₃ – CO – O – CH₂ – CH₃ + H₂O
- Formació d’amides: reacció entre dos àcids carboxílics quan reaccionen amb amides primàries o secundàries. Els productes de la reacció són amides i aigua que es desprèn. Una reacció a destacar d’aquest tipus és la que s’utilitza en la unió dels aminoàcids per formar pèptids.
- CH₃ – COOH + CH₃ – NH₂ → CH₃ – CO – NH – CH₃ + H₂O
Principals reaccions dels grups funcionals
[modifica]- Combustió: com tots els hidrocarburs produeix CO₂ i H₂O. Model re combustió d’alcans: CnH₂n+₂ + (n+1)/2O₂ → nCO₂ + (n+1)H₂O
- Substitució: es substitueix l’H normalment per Cl o Br.
- Halogenació: substitució realitzada de forma radicalària en cadena, molt difícil de controlar. CH₄ + Cl₂ → CH₃Cl + HCl
Hidrocarburs insaturats
[modifica]- Hidrogenació: en presència d’un catalitzador com el Pt s’addiciona un hidrogen a cada carboni de doble enllaç.
- CH≡C-CH₃ + H₂ → CH₂=CH-CH₃
- CH₂=CH-CH₃ + H₂ → CH₃-CH₂-CH₃
- Addició d’halògens: l’halogen es pot addicionar als dobles o triples enllaços.
- CH≡C-CH₃ + Cl₂ → CHCl=ClC-CH₃
- CHCl-CCl-CH₃ + Cl₂ → CHCl₂-CCl₂-CH₃
- Addició d’halurs d’hidrogen: l’hidrogen s’addiciona al carboni més hidrogenat com diu la regla de Markovnikov.
- CH≡C-CH₃ + HCl → CH₂=ClC-CH₃
- CH₂=ClC-CH₃ + HCl → CH₃-CCl₂-CH₃
- Addició d’aigua: l’hidrogen de l’aigua entra en el carboni més hidrogenat i el grup hidroxil en un altre carboni.
- CH≡C-CH₃ + H₂O → CH₂=COH-CH₃
- CH₂=CH-CH₃ + H₂O → CH₃-CHOH-CH₃
- Combustió: tots els hidrocarburs donen lloc a CO₂ i H₂O.
- CnH₂n + n/₂O₂ → nCO₂ + nH₂O
Arens
[modifica]- Halogenació: en presència dels catalitzadors AlCl₃ i FeBr₃ se substitueixen els hidrògens. C₆H₆ + Br₂ → C₆H₅Br + HBr
- Alquilació: es substitueixen els halurs d’hidrogen. C₆H₆ + BrCH₂CH₃ → C₆H₅-CH₂CH₃+ HBr
- Nitració: es realitza amb àcid nítric dissolt en àcid sulfúric concentrat. C₆H₆ + HNO₃ → C₆H₅NO₂ + H₂O
- Combustió: tot els hidrocarburs la sofreixen. C₆H₆ + 9/2O₂ →3CO₂ + 3H₂O
Amides
[modifica]- Hidròlisi: dona com a productes àcids carboxílics. Té lloc en medis àcids o bàsics.
- Reducció: la reacció amb l’hidrur d’alumini i el liti les transforma en amines. La reducció amb DIBAL dona aldehids com a productes.
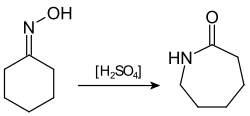
- Transposició: en presència d’una base les amines primàries reaccionen amb Br₂ substituint el grup carbonil per un grup amino. Aquesta reacció s’anomena transposició de Hoffmann.
- Eliminació: donen alquens com a producte. Aquesta reacció s’anomena eliminació de Hofmann i Cope.
- Reacció de Mannich: el metanal es condensa amb amoníac, amines primàries o secundàries, per formar 3-aminocarbonils.
- Substitució: es substitueix sempre H o OH. Exemple: CH₃CHOHCH₃ + HBr → CH₃CHBrCH₃ + H₂O
- Deshidratació: reacció d’eliminació que es fa en medi sulfíric. Pot ser intra o intermolecular i obtenim olefines i éters respectivament.
- CH₃CHOHCH₃ → CH₃CH=CH₂ + H₂O
- 2CH₃CH₂OH → CH₃CH₂-O-CH₂CH₃ + H₂O
- Esterificació: reaccionen amb àcid per donar lloc a ésters. CH₃CH₂OH + CH₃COOH → CH₃COO CH₂CH₃ + H₂O
- Oxidació: s’oxiden bàsicament amb dues espècies: amb permanganat donant lloc a aldehids o amb dicromat donant com a producte cetones.
- CH₃CH₂OH + KMnO₄ → CH₃CHO
- CH₃CHOHCH₃ + KMnO4 → CH₃CO CH₃
- Oxidació: els aldehids s’oxiden fàcilment donant lloc a àcids. CH₃CHO (Ox) → CH₃COOH
- Reducció: els aldehids es redueixen amab hidrur d’alumini i bor fins a alcohols. CH₃CHO (Red) → CH₃CH₂OH
- Esterificació: reaccionen amb alcohol donant lloc a ésters. CH₃CH₂OH + CH₃COOH → CH₃COO CH₂CH₃ + H₂O
Àcids carboxílics
[modifica]- Addició – eliminació: al reacciona amb alcohol donen lloc a ésters
- La reacció amb alcohol dona lloc a ésters
- La reacció amb amines produeix amides
- La reacció amb PBr₃ dona lloc a halurs d’alcans
- Reducció: amb hidrur d’alumini i liti els àcids carboxílics es redueixen a alcohols. És una reacció en dues etapes: desprotonació de l‘hidrogen i atac del nucleòfil reductor al carbonil.
- Halogenació: es realitza amb Br₃ o PBr₃. És l’anomenada reacció de Hell-Volhard-Zelinski.
Esters
[modifica]- Hidròlisi: està catalitzada per àcids o bases i dona com a productes àcids carboxílics.
- Transesterificació: reaccionen amb alcohols amb catàlisis àcides o bàsiques obtenint un nou ester sense que sigui necessari passar per l’àcid carboxílic lliure.
- Reducció: l’hidrur d’alumini i el liti els transformen en alcohols.
- Condensació: en medis bàsics formen enolats que condensen generant 3-cetoesters. Aquesta reacció s’anomena condensació de Claisen.
Bibliografia
[modifica]- J. McMurryc. Química orgánica, 2005.
- J. De Guevara et al.. Química de las reacciones orgánicas, 1969.
- Lehninger. Editorial Omega. Principios de bioquímica. 4a edició, 2006.
- D. Voet et J. G. Voet. Editorial panamericana. Bioquímica. 3a ed., 2006.
- L. Stryer. Bioquímica, 1976.
- W.Müller-Esterl. Editorial Reverté. Bioquímica, 2008.
- [ http://www.stolaf.edu/depts/chemistry/courses/toolkits/247/practice/medialib/data/]
- [ https://www.organic-chemistry.org/namedreactions/]
- [ http://www.chem.wisc.edu/areas/reich/handouts/NameReagents/namedreag-cont.htm]
