Kemik iyileşmesi

Kemik iyileşmesi veya kırık iyileşmesi, vücudun bir kemik kırığının onarımını kolaylaştırdığı proliferatif bir fizyolojik süreçtir.
Genellikle kemik kırığı tedavisi, yerinden oynayan kemiklerin anestezi ile veya anesteziksiz olmayan yer değiştirme yöntemiyle azaltılması (bastırılması), kaynamaya yardımcı olmak için pozisyonlarını stabilize eden ve daha sonra kemiğin doğal iyileşme sürecinin oluşmasını bekleyen bir doktoru kapsar.
Yeterli besin alımı, kırık onarımının bütünlüğünü önemli ölçüde etkilediği bulunmuştur.[1] Yaş, kemik türü, ilaç tedavisi ve önceden mevcut kemik patolojisi iyileşmeyi etkileyen faktörlerdir. Kemik iyileşmesinin rolü, diğer dokularda görülen yara izi olmaksızın yapısal bir güçsüzlük veya şekil bozukluğu olan yeni kemik üretmektir.[2]
Kemik oluşumu genellikle iyileşme sürecinin tamamı boyunca uzanırken bazı durumlarda kırık içindeki kemik iliği son yeniden şekillendirme aşamasından iki veya daha az hafta önce iyileşmiştir.[kaynak belirtilmeli]
İmmobilizasyon ve ameliyat iyileşmeyi kolaylaştırabilirken, bir kırık fizyolojik süreçler yoluyla iyileşir. İyileşme süreci esas olarak periost (kemiği kapsayan bağ dokusu zarı) tarafından belirlenir. Periost, kemik iyileşmesi için gerekli olan kondroblastlara ve osteoblastlara dönüşen bir öncü hücrelerin bir kaynağıdır. Kemik iliği (varsa), endosteum, küçük kan damarları ve fibroblastlar, öncü hücrelerin diğer kaynaklarıdır.[3]
Aşamaları
[değiştir | kaynağı değiştir]Kırık iyileşmesinde üç ana aşama vardır;[4] bunlardan ikisi toplamda beş aşama yapmak üzere daha alt bölümlere ayrılabilir.[kaynak belirtilmeli]
- 1. Tepkisel aşama
- i. Kırık ve inflamatuar aşaması
- ii. Granülasyon dokusu oluşumu
- 2. Onarım aşaması
- iii. Kıkırdak kalus oluşumu
- iv. Lameller kemik birikimi
- 3. Yeniden şekillendirme aşaması
- v. Orijinal kemik konturuna yeniden şekillenme
Tepkisel aşama
[değiştir | kaynağı değiştir]Kırıktan sonra, ışık ve elektron mikroskopisi ile görülen ilk değişiklik, hasar alanına bitişik dokulardaki kan hücrelerinin varlığıdır. Çatlaklardan hemen sonra kan damarları daralır ve kanamayı durdurur.[5] Kırıktan sonra birkaç saat içinde, ekstravasküler kan hücreleri, hematom olarak bilinen bir kan pıhtısı oluştururlar. Bu hücreler sitokinleri serbest bırakır ve kan kılcal geçirgenliğini arttırır. Kan pıhtısı içindeki tüm hücreler dejenere olur ve ölürler.[6] Kan pıhtısı dışındaki bazı hücreler, ancak yaralanma bölgesine bitişik olan hücreler de dejenere olur ve ölürler.[7] Bu aynı alanda fibroblastlar hayatta kalır ve çoğalırlar. Granülasyon dokusu olarak bilinen küçük kan damarları serpiştirilmiş gevşek bir hücre kümesi oluştururlar.[8] Bu doku, kırık alanı boyunca gerginliği azaltır. Osteoklastlar ölü kemik uçlarını tekrar emmeye başlarlar ve diğer nekrotik dokular kaldırılır.[9]
Onarım aşaması
[değiştir | kaynağı değiştir]Kırıklardan sonraki günlerde, periost çoğaltır ve dönüştürür. Kırık aralığının yakınında (yakın tarafında) bulunan periosteal hücreler hiyalin kıkırdak oluşturan kondroblastlara dönüşürler. Kırık aralığının distalindeki (en uzak ucundaki) periost hücreleri osteoblastlara dönüşür ve doku kemik oluşur. Granülasyon dokusundaki fibroblastlar hiyalin kıkırdak da oluşturan kondroblastlara dönüşür.[10] Bu iki yeni doku kırıkların diğer kısımlarındaki karşılıklarıyla birleşinceye kadar büyür. Bu işlemler, "kırık kallus" olarak bilinen heterojen bir doku kütlesi ile sonuçlanır.[11] Sonunda kırılma aralığı, hiyalin kıkırdak ve dokuma kemik tarafından köprülenir ve bazı kemiklerin orijinal gücünü geri kazandırır.
Sonraki aşama, hiyalin kıkırdak ve doku kemiklerinin lamellar kemik ile değiştirilmesidir. Değiştirme işlemi, hiyalin kıkırdak ve kemik substitüsyonuna göre endokondral kemikleşme olarak bilinir. Dokuma kemiğin lamellar kemik ile ikame edilmesi hiyalin kıkırdakın katmanlı kemik ile değiştirilmesinden önce gelir. Her iki dokudaki kollajen matrisi mineralleştikten hemen sonra tabakalı kemik oluşmaya başlar. Bu noktada, mineralize matris, her biri bir mikrodamar ve sayısız osteoblast içeren kanallarla nüfuz eder. Osteoblastlar mineralize matrisin yakın zamanda maruz kaldığı yüzey üzerine yeni katmanlı kemik oluştururlar. Bu yeni katmanlı kemik trabeküler kemik şeklindedir.[12] Sonunda orijinal kırık kalusunun dokuma kemik ve kıkırdağı, kemiğin orijinal gücünün çoğunu geri yükleyerek trabeküler kemik ile değiştirilir.
Yeniden şekillendirme aşaması
[değiştir | kaynağı değiştir]Yeniden şekillendirme işlemi, trabeküler kemiğin kompakt kemikle yer değiştirmesine yol açar. Trabeküler kemik ilk olarak osteoklastlar tarafından emilir ve "Howship lakünası" olarak bilinen sığ bir rezervuar çukuru oluşturur. Daha sonra osteoblastlar resorpsiyon çukuru içinde kompakt kemik biriktirir. Sonunda, kırık kallus, kemiğin orijinal şekli ve kuvveti ile yakından eşleşen yeni bir şekle dönüştürülür. Yeniden şekillenme aşaması yaş veya genel durum gibi faktörlere bağlı olarak 3-5 yıl sürer.[8] Bu süreç, osteokonduktif olan ve aktif olarak kemik iyileşmesini destekleyen, cerament gibi belirli sentetik enjekte edilebilir biyomalzemelerle geliştirilebilir.[13]
Kemik iyileşmesine engeller
[değiştir | kaynağı değiştir]
- Osteositlerin ölümüne yol açan zayıf kan kaynağı. Kemik hücresi ölümü aynı zamanda kırık derecesine ve Havers sistemi bozulmasına bağlıdır.
- Yumuşak dokuların durumu. Kemik uçları arasında yumuşak doku iyileşmeyi kısıtlar.
- Beslenme ve ilaç tedavisi. Zayıf genel sağlık iyileşme hızını azaltır. Enflamatuar yanıtı bozan ilaçlar da iyileşmeyi engellemektedir.
- Enfeksiyon. Enflamatuar cevabı, enfeksiyonu savuşturmaya yönelik iyileştirmeyi uzaklaştıracak şekilde yönlendirir.
- Yaş. Genç kemik, yetişkin kemikten daha hızlı birleştirir.
- Önceden var olan kemik malignansı.
- Kemik hizalanmamak ve çok fazla veya çok az hareket gibi mekanik faktörler. Aşırı hareketlilik köprü kallusunu bozarak birleşmeye müdahale edebilir; ancak hafif biyomekanik hareketin, kallus oluşumunu iyileştirdiği görülür.[9]
Komplikasyonlar
[değiştir | kaynağı değiştir]Kırık iyileşmesinin komplikasyonları:
- Enfeksiyon: Bu kırıkların en sık görülen komplikasyonudur ve çoğunlukla açık kırıklarda görülür. Post-travmatik yara enfeksiyonu, hastalarda kronik osteomyelitin en sık nedenidir. Osteomyelit, bir kırığın cerrahi fiksasyonundan sonra da ortaya çıkabilir.[14]
- Nonunion: Bir kırık oluştuktan sonraki altı ay içinde iyileşmenin ilerlemesi yoktur. Kırık parçalar ayrılmış olarak kalır ve kemiğe enfeksiyon ve / veya kan dolaşımının eksikliği (iskemi) neden olabilir.[15] Atrofik ve hipertrofik olmak üzere iki tip nonunion vardır. Hipertrofik, sklerotik görünen kemik uçlarına götüren aşırı kaloz oluşumunu içerir ve radyolojik bir "Fil Ayağı" görünümüne neden olur. Atrofik nonunion kemik uçlarının tekrar emilmesi ve yuvarlanması ile sonuçlanır.[9]
- Malunion: İyileşme meydana gelir ancak iyileşmiş kemiğin 'açısal deformite, translasyon veya cerrahi düzeltme gerektiren rotasyonel hizalama' vardır. Bu durum, femur gibi uzun kemiklerde en yaygın olanıdır.[16]
- Gecikmiş kaynama: İyileşme süreleri bir kırığa ve bir hastanın yaşına bağlı olarak değişir. Gecikmiş kaynama, röntgen filminde 'kırık çizgisinin kalıcılığı ve kallus oluşumunda kıtlık veya eksiklik' ile karakterizedir. İyileşme halen devam etmekte ancak normalden çok daha yavaş bir oranda gerçekleşmektedir.[15]
Galeri
[değiştir | kaynağı değiştir]-
Dokuma kemiklerin kolajen lifleri
-
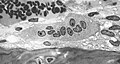
"Köpüklü" sitoplazması içerisinde birçok çekirdek gösteren osteoklast
-
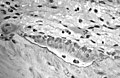
Trabeküler kemikteki bir rezorpsiyon çukuru içinde iki osteosit içeren kompakt kemik oluşturan osteoblastlar
Dipnotlar
[değiştir | kaynağı değiştir]- ^ Susan E. Brown, PhD. "How to Speed Fracture Healing" (PDF). Center for Better Bones. 19 Kasım 2016 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 7 Ekim 2017.
Hiçbir bilim adamı kırık iyileşmesi için 20 temel besin maddesini kullanan bir klinik araştırma yapmamasına rağmen, çok sayıda çalışma çoklu besleyici tedavinin komplikasyonu azalttığı ve kırık iyileşmesini hızlandırdığını bulmuştur.
- ^ Gomez-Barrena E, Rosset P, Lozano D, Stanovici J, Ermthaller C, Gerbhard F. Bone fracture healing: Cell therapy in delayed unions and nonunions. Bone. 2015;70:93–101.
- ^ Ferretti C, Mattioli-Belmonte M. Periosteum derived stem cells for regenerative medicine proposals: Boosting current knowledge. World Journal of Stem Cells. 2014;6(3):266-277. doi:10.4252/wjsc.v6.i3.266.
- ^ Iain H. Kalfas, MD (2001). "Principles of Bone Healing". WebMD LLC. 3 Nisan 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Ekim 2017.
- ^ Brighton and Hunt (1997), p. 248: The extravascular blood cells are identified as erythrocytes, platelets and neutrophils.
- ^ Brighton and Hunt (1991), p. 837: The cells within the clot are identified.
- ^ Brighton and Hunt (1997)
- ^ a b Ham and Harris
- ^ a b c Nyary Tamas, Scamell BE. (2015). Principles of bone and joint injuries and their healing. Surgery(Oxford). 33 (1), p 7-14.
- ^ Brighton and Hunt (1997), p. 248: Two light micrographs showing the cells of the woven bone and hyaline cartilage.
- ^ Brighton and Hunt (1986), p. 704: Two light micrographs of a typical fracture callus: one showing the tissues and the other showing the cells.
- ^ Brighton and Hunt (1986); Brighton and Hunt (1997); Ham and Harris
- ^ Hatten Jr., H.P. and Voor, J. (2012): Bone Healing Using a Bi-Phasic Ceramic Bone Substitute Demonstrated in Human Vertebroplasty and with Histology in a Rabbit Cancellous Bone Defect Model. Interventional Neuroradiology, vol. 18, pp. 105-113.
- ^ Rowbotham, Emma; Barron, Dominic (2009). "Radiology of fracture complications". Orthopaedics and Trauma. 23 (1). ss. 52-60. doi:10.1016/j.mporth.2008.12.008.
- ^ a b Jahagirdar, Rajeev; Scammell, Brigitte E (2008). "Principles of fracture healing and disorders of bone union". Surgery. 27 (2). ss. 63-69. doi:10.1016/j.mpsur.2008.12.011.
- ^ Chen, Andrew T; Vallier, Heather A (2016). "Noncontiguous and open fractures of the lower extremity: Epidemiology, complications, and unplanned procedures". Injury. 47 (3). ss. 742-747. doi:10.1016/j.injury.2015.12.013.
Kaynakça
[değiştir | kaynağı değiştir]- Brighton, Carl T. and Robert M. Hunt (1986), "Histochemical localization of calcium in the fracture callus with potassium pyroantimonate: possible role of chondrocyte mitochondrial calcium in callus calcification", Journal of Bone and Joint Surgery, 68-A (5): 703-715
- Brighton, Carl T. and Robert M. Hunt (1991), "Early histologic and ultrastructural changes in medullary fracture callus", Journal of Bone and Joint Surgery, 73-A (6): 832-847
- Brighton, Carl T. and Robert M. Hunt (1997), "Early histologic and ultrastructural changes in microvessels of periosteal callus", Journal of Orthopaedic Trauma, 11 (4): 244-253
- Ham, Arthur W. and William R. Harris (1972), "Repair and transplantation of bone", The biochemistry and physiology of bone, New York: Academic Press, p. 337-399