โอโซน
| |||
| |||
| ชื่อ | |||
|---|---|---|---|
| IUPAC name
Ozone
| |||
| Systematic IUPAC name
Trioxygen | |||
| ชื่ออื่น
2λ4-trioxidiene; catena-trioxygen
| |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| เคมสไปเดอร์ | |||
| ECHA InfoCard | 100.030.051 | ||
| EC Number |
| ||
| 1101 | |||
| MeSH | Ozone | ||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
| O3 | |||
| มวลโมเลกุล | 47.997 g·mol−1 | ||
| ลักษณะทางกายภาพ | แก๊สไม่มีสีถึงสีน้ำเงินอ่อน[1] | ||
| กลิ่น | ฉุน[1] | ||
| ความหนาแน่น | 2.144 g/L (at 0 °C) | ||
| จุดหลอมเหลว | −192.2 องศาเซลเซียส; −313.9 องศาฟาเรนไฮต์; 81.0 เคลวิน | ||
| จุดเดือด | −112 องศาเซลเซียส; −170 องศาฟาเรนไฮต์; 161 เคลวิน | ||
| 1.05 g L−1 (at 0 °C) | |||
| ความสามารถละลายได้ ใน ตัวทำละลายอื่น ๆ | ละลายได้มากใน CCl4, กรดซัลฟิวริก | ||
| ความดันไอ | 55.7 atm[2] (−12.15 องศาเซลเซียส หรือ 10.13 องศาฟาเรนไฮต์ หรือ 261.00 เคลวิน)[a] | ||
| กรด | Protonated ozone | ||
| +6.7·10−6 cm3/mol | |||
ดัชนีหักเหแสง (nD)
|
1.2226 (liquid), 1.00052 (gas, STP, 546 nm—note high dispersion)[3] | ||
| โครงสร้าง | |||
| C2v | |||
| Digonal | |||
| Dihedral | |||
| Hybridisation | sp2 for O1 | ||
| 0.53 D | |||
| อุณหเคมี | |||
Std molar
entropy (S⦵298) |
238.92 J K−1 mol−1 | ||
Std enthalpy of
formation (ΔfH⦵298) |
142.67 kJ mol−1 | ||
| ความอันตราย | |||
| GHS labelling: | |||
    
| |||
| อัน���ราย | |||
| H270, H314 | |||
| NFPA 704 (fire diamond) | |||
| ปริมาณหรือความเข้มข้น (LD, LC): | |||
LCLo (lowest published)
|
12.6 ppm (mouse, 3 hr) 50 ppm (human, 30 min) 36 ppm (rabbit, 3 hr) 21 ppm (mouse, 3 hr) 21.8 ppm (rat, 3 hr) 24.8 ppm (guinea pig, 3 hr) 4.8 ppm (rat, 4 hr)[4] | ||
| NIOSH (US health exposure limits): | |||
PEL (Permissible)
|
TWA 0.1 ppm (0.2 mg/m3)[1] | ||
REL (Recommended)
|
C 0.1 ppm (0.2 mg/m3)[1] | ||
IDLH (Immediate danger)
|
5 ppm[1] | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
สารประกอบที่เกี่ยวข้อง
|
ซัลเฟอร์ไดออกไซด์ Trisulfur Disulfur monoxide Cyclic ozone | ||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
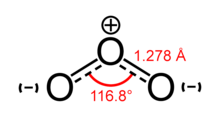
โอโซน (Ozone หรือ O3) เป็นโมเลกุลที่ประกอบจาก ออกซิเจน 3 อะตอม เกิดจากการรวมตัวกันของแก๊สออกซิเจน 1 โมเลกุลกับอะตอมออกซิเจนอิสระ 1 อะตอมที่แตกตัวจากแก๊สออกซิเจนโดยการกระตุ้นของรังสีอัลตร้าไวโอเลตซี (UV-C) ปรากฏอยู่ในชั้นบรรยากาศของโลกโดยที่ชั้นสตราโทสเฟียร์ (Stratosphere) ซึ่งเป็นบรรยากาศที่ระดับความสูงระหว่าง 10 - 50 กิโลเมตรจากผิวดินเป็นชั้นบรรยากาศที่มีโอโซนหนาแน่นที่สุด หรืออาจกล่าวได้ว่าเป็นชั้นที่ผลิตแหล่งแก๊สโอโซน โดยชั้นโอโซนดังกล่าวทำหน้าที่เป็นเกราะคุ้มกัน ปกป้องพืชและสัตว์จากรังสีที่แผ่ออกมาจากดวงอาทิตย์ โดยเฉพาะรังสีอัลตร้าไวโอเลตบี (UV-B) ซึ่งเป็นรังสีที่เป็นอันตรายต่อชีวิตและธรรมชาติหากได้รับในปริมาณที่มากเกินไป
แก๊สโอโซนถูกค้นพบครั้งแรกโดยนักเคมีชาวดัตช์ ชื่อ วอน มารุม (Van Marum) จากอุปกรณ์จับปริมาณก๊าซ โดยนายมารุมได้กลิ่นที่เป็นเอกลักษณ์รอบๆ ขั้วผลิตกระแสไฟฟ้าจากอุปกรณ์ชุดทดลองของเขา อย่างไรก็ตาม การค้นพบโอโซนได้ถูกบันทึกเป็นลายลักษณ์อักษรในปี ค.ศ. 1840 คือ คริสเตียน ฟรีดริช เชินไบน์ (Christian Friedrich Schönbein) นักเคมีชาวเยอรมัน โดยเขาตั้งชื่อก๊าซตามภาษากรีกคำว่า ozein ซึ่งแปลว่ากลิ่น หลังจากนั้น เครื่องผลิตโอโซนเครื่องแรกได้ถูกผลิตโดย วอน ซีเมนต์ (Von Siemens) ในกรุงเบอร์ลิน (Berlin)[3]
โอโซนเข้มข้นมีสีฟ้าที่อุณหภูมิและความดันมาตรฐาน (Standard Temperature and Pressure; STP) เมื่ออุณหภูมิลดลงถึง -112 °C โอโซนจะเป็นเป็นของเหลวสีน้ำเงิน และเมื่ออุณหภูมิลดต่ำกว่า -193 °C ก็จะกลายเป็นของแข็งสีดำ
มนุษย์ได้นำโอโซนไปใช้ประโยชน์ในหลาย ๆ ด้าน เช่น นำไปใช้เป็นสารตั้งต้นในการผลิตเคมีภัณฑ์ นำไปใช้เป็นสารซักฟอก ใช้ฆ่าแบคทีเรีย เป็นต้น แก๊สโอโซนจัดเป็นก๊าซพิษ การสูดดมแก๊สโอโซนเป็นอันตรายต่อระบบทางเดินหายใจ[5][6] ซึ่งแตกต่างจากคำว่าโอโซนที่บางครั้งถูกใช้ในบริบทของการท่องเที่ยวหรือการพักผ่อนหย่อนใจ เช่นในวลีว่า "สูดโอโซน", "รับโอโซน" หรือ "แหล่งโอโซน" เป็นต้น ถือว่าเป็นการใช้โอโซนผิดความหมาย เพราะความจริงแล้วโอโซนมีความเป็นพิษต่อมนุษย์ บริเวณที่มีโอโซนมากในประเทศไทย ได้แก่ นิคมอุตสาหกรรมแก่งคอย นิคมอุตสาหกรรมมาบตาพุด และย่านถนนสีลมในกรุงเทพมหานคร คำว่าโอโซนที่คนจำนวนมากใช้กันผิด ๆ ก็คือ ไปใช้ในเชิงการสื่อความหมายถึงออกซิเจนหรืออากาศบริสุทธิ์ซึ่งดีต่อระบบการหายใจ โดยไม่รู้ความจริงว่าแท้จริงแล้วแก๊สโอโซนมีความเป็นพิษสูงและมีอันตรายต่อสุขภาพ[5][6]
เชิงอรรถ
[แก้]หมายเหตุ
- ↑ This vapor pressure is for the critical temperature, which is below room temperature.
อ้างอิง
- ↑ 1.0 1.1 1.2 1.3 1.4 NIOSH Pocket Guide to Chemical Hazards. "#0476". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Gas Encyclopedia; Ozone
- ↑ Cuthbertson, Clive; Cuthbertson, Maude (1914). "On the Refraction and Dispersion of the Halogens, Halogen Acids, Ozone, Steam Oxides of Nitrogen, and Ammonia". Philosophical Transactions of the Royal Society A. 213 (497–508): 1–26. Bibcode:1914RSPTA.213....1C. doi:10.1098/rsta.1914.0001. สืบค้นเมื่อ 4 February 2016.
- ↑ "Ozone". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ 5.0 5.1 สูดโอโซน ดีจริงหรือ?
- ↑ 6.0 6.1 หยุดเลย! หากคิดจะรีเฟรชร่างกายด้วยการไป "สูดโอโซน"
อ่านเพิ่ม
[แก้]- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- Becker, K. H., U. Kogelschatz, K. H. Schoenbach, R. J. Barker (ed.). Non-Equilibrium Air Plasmas at Atmospheric Pressure. Series in Plasma Physics. Bristol and Philadelphia: Institute of Physics Publishing Ltd; ISBN 0-7503-0962-8; 2005
- United States Environmental Protection Agency. Risk and Benefits Group. (August 2014). Health Risk and Exposure Assessment for Ozone: Final Report.
แหล่งข้อมูลอื่น
[แก้]- International Ozone Association
- European Environment Agency's near real-time ozone map (ozoneweb)
- NASA's Ozone Resource Page เก็บถาวร 2013-04-06 ที่ เวย์แบ็กแมชชีน
- OSHA Ozone Information เก็บถาวร 2016-01-20 ที่ เวย์แบ็กแมชชีน
- Paul Crutzen Interview—Video of Nobel Laureate Paul Crutzen talking to Nobel Laureate Harry Kroto by the Vega Science Trust
- NASA's Earth Observatory article on Ozone
- International Chemical Safety Card 0068
- NIOSH Pocket Guide to Chemical Hazards
- National Institute of Environmental Health Sciences, Ozone Information
- Ground-level Ozone Air Pollution
- NASA Study Links "Smog" to Arctic Warming—NASA Goddard Institute for Space Studies (GISS) study shows the warming effect of ozone in the Arctic during winter and spring.
- Ground-level ozone information from the American Lung Association of New England



