Дифтамид
| Дифтамид | |
|---|---|
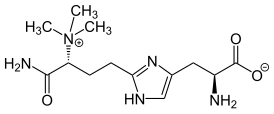 | |
| Общие | |
| Систематическое наименование |
|
| Традиционные названия | 2-(3-Карбоксамидо-3(триметиламмонио)пропил)гистидин |
| Хим. формула | C13H23N5O3 |
| Физические свойства | |
| Состояние | бесцветные кристаллы |
| Молярная масса | 297.353 г/моль |
| Классификация | |
| Рег. номер CAS | 75645-22-6 |
| PubChem | 70789228 |
| SMILES | |
| InChI | |
| ChEBI | 15949 и 57580 |
| ChemSpider | 4573817 |
| Безопасность | |
| Краткие характер. опасности (H) |
H201, H202, H235+H410 |
| Меры предостор. (P) |
P201 |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дифтамид — некодируемая аминокислота, производное гистидина, обнаруживаемая исключительно в факторе элонгации эукариот eEF-2 и некоторых архей. Синтезируется в ходе посттрансляционной модификации и является мишенью для моно-АДФ-рибозилирования в процессе регуляции рибосомального синтеза белка.
Дифтамид обнаружен при исследовании механизма действия дифтерийного токсина, благодаря чему и получил название. Известно по крайней мере пять АДФ-рибозилирующих токсинов (коклюшный, холерный и дифтерийный токсины, LT-токсин кишечной палочки и экзотоксин А псевдомонад) имеют общий НАД-связывающий сайт, три из них (дифтерийный, холерный, экзотоксин А) являются дифтамид-зависимыми[1],[2].
Биосинтез
[править | править код]Несмотря на то, что дифтамид известен в течение более чем двух десятилетий, детали начальных стадий его биосинтеза остаются неясными.
Первая стадия биосинтеза дифтамида — перенос 3-карбокси-3-аминопропильного остатка на гистидиновый остаток белковой цепи eEF-2[3]. Донором остатка является S-аденозилметионин (SAM), при этом происходит нуклеофильная атака имидазольного фрагмента гистидина на активированный сульфониевым центром углерод SAM. В отличие от большинства подобных реакций с участием SAM, которые проходят как нуклеофильные атаки по углероду метильной группы и ведут к её переносу на нуклеофильный субстрат, при биосинтезе дифтамида происходит перенос не метильной группы, а 3-карбокси-3-аминопропильного остатка на углеродный атом в положении 2 имидазольного кольца гистидина с образованием 2-(3-карбокси-3-аминопропил)-L-гистидина.
На следующей стадии аминогруппа 3-аминопропильного фрагмента остатка 2-(3-карбокси-3-аминопропил)-L-гистидина подвергается исчерпывающему метилированию с образованием остатка дифнина (2-[3-карбокси-3-(триметиламмонио)пропил]-L-гистидина), эта реакция катализируется ферментом дифтин синтазой (КФ 2.1.1.98), в качестве донора метильной группы выступает S-аденозилметионин[4].
На последней стадии карбоксильная группа дифтина при взаимодействии с аммиаком, катализируемым дифтин-аммиак лигазой (КФ 6.3.1.14), превращается в амидную с образованием дифтамида[5]
Примечания
[править | править код]- ↑ Information on EC 2.4.2.36 - NAD+-diphthamide ADP-ribosyltransferase // BRENDA. Дата обращения: 4 июля 2013. Архивировано 10 июля 2013 года.
- ↑ Супотницкий, М. В. Бактериальные токсины. Их природа, механизмы действия, возможности конструирования гибридных и модифицированных токсинов. Биопрепараты. Дата обращения: 4 июля 2013. Архивировано из оригинала 18 июля 2013 года.
- ↑ у млекопитающих — в позиции 715, у дрожжей — 699, у Pyrococcus horikoshii — 600
- ↑ EC 2.1.1.98 // IUBMB Enzyme Nomenclature. Дата обращения: 14 мая 2013. Архивировано 23 мая 2013 года.
- ↑ EC 6.3.1.14 // IUBMB Enzyme Nomenclature. Дата обращения: 14 мая 2013. Архивировано 20 октября 2012 года.
