Infliksymab
| ||
| Identyfikacja | ||
| numer CAS | ||
|---|---|---|
| DrugBank | ||
| Klasyfikacja medyczna | ||
| ATC | ||
| Stosowanie w ciąży |
kategoria B | |
| Farmakokinetyka | ||
| Działanie |
immunosupresyjne | |
| Procent wchłaniania |
100% | |
| Biodostępność |
100% | |
| Okres półtrwania |
8–12 dni | |
| Metabolizm |
opsonizacja | |
| Uwagi terapeutyczne | ||
| Drogi podawania |
dożylnie | |
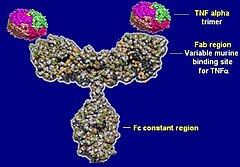
Infliksymab, infliksimab (łac. infliximabum) – chimeryczne ludzko-mysie przeciwciało monoklonalne klasy IgG1[1][2], wiążące się z dużym powinowactwem zarówno z rozpuszczalną, jak i transbłonową formą ludzkiego czynnika martwicy nowotworów TNF-alfa (tumour necrosis factor). Infliksymab tworzy in vivo stabilne kompleksy z ludzkim TNF-alfa, co jest równoznaczne z utratą aktywności biologicznej przez tę cytokinę.
Wraz z adalimumabem stanowi parę leków biologicznych podlegających refundacji w Polsce w ramach programu terapeutycznego NFZ w leczeniu choroby Leśniowskiego-Crohna[3].
Wskazania do stosowania leku
[edytuj | edytuj kod]Infliksymab jest lekiem biologicznym wykorzystywanym w terapii niektórych chorób o potwierdzonej lub podejrzewanej etiologii autoimmmunologicznej, w których patofizjologii bierze udział TNF-alfa. Obecnie infliksymab stosowany jest w leczeniu następujących jednostek chorobowych:
- reumatoidalne zapalenie stawów[4][5][6]
- choroba Leśniowskiego-Crohna[1][2]
- wrzodziejące zapalenie jelita grubego[7]
- zesztywniające zapalenie stawów kręgosłupa[8]
- łuszczycowe zapalenie stawów[9]
- łuszczyca[10][11][12].
Prowadzone są także badania kliniczne wykorzystujące infliksymab w leczeniu układowych zapaleń naczyń[13] (np. w chorobie Behçeta[14]).
Przeciwwskazania
[edytuj | edytuj kod]- gruźlica
- sepsa
- ropnie
- zakażenia oportunistyczne
- niewydolność serca klasy III lub IV NYHA
- nadwrażliwość na jakikolwiek składnik preparatu.
Działania niepożądane
[edytuj | edytuj kod]Działania niepożądane infliksymabu obserwowane w trakcie badań klinicznych oraz po wprowadzeniu leku do obrotu:
- zakażenia wirusowe, objawy choroby posurowiczej[15], bóle (niekiedy bardzo silne) i zawroty głowy, zaczerwienienie twarzy, nudności, biegunka, ból brzucha, dyspepsja, pokrzywka, świąd skóry, znużenie, ból w klatce piersiowej, gorączka, wzrost aktywności aminotransferaz wątrobowych
- Niektóre badania (m.in. holenderskie) sugerują, że immunosupresja – również przy użyciu leków biologicznych – może zwiększać częstość powstawania zmian barwnikowych o charakterze łagodnym[16].
- Ponadto występowały zakażenia bakteryjne, grzybicze, gruźlica, niedokrwistość, leukopenia, małopłytkowość, toczeń polekowy[15], reakcje alergiczne, anafilaksja[1][15], depresja, zaburzenia świadomości, demielinizacja, zaburzenia rytmu i nasilenie niewydolności serca, nadciśnienie tętnicze i hipotonia, krwawienia z nosa, krwotok z przewodu pokarmowego, zapalenie wątroby, bóle mięśni i stawów, bardzo rzadko: groźny chłoniak T-komórkowy wątroby i śledziony (podejrzewa się wzrost ryzyka przy jednoczesnym stosowaniu wysokich dawek azatiopryny).
Interakcje
[edytuj | edytuj kod]- U pacjentów z reumatoidalnym zapaleniem stawów, łuszczycowym zapaleniem stawów i chorobą Crohna obserwowano, że jednoczesne podawanie metotreksatu lub innych leków immunomodulujących oraz infliksymabu zwiększało jego stężenie we krwi. Wyniki tych obserwacji nie są jednak pewne.
- Nie zaleca się kojarzenia infliksymabu z anakinrą.
- Nie są znane inne interakcje pomiędzy infliksymabem a pozostałymi związkami czynnymi.
Stosowanie leku w ciąży i w czasie karmienia piersią
[edytuj | edytuj kod]- Obecne doświadczenie kliniczne jest zbyt ograniczone aby wykluczyć ryzyko i dlatego nie zaleca się stosowania infliksymabu w ciąży. Podejrzewa się, że infliksymab podawany w czasie ciąży może upośledzać prawidłową odpowiedź immunologiczną u noworodków.
- Nie wiadomo czy infliksymab jest wydalany z mlekiem ludzkim i czy jest wchłaniany po podaniu doustnym. Uznaje się, że kobiety nie powinny karmić piersią co najmniej przez 6 miesięcy po leczeniu infliksymabem.
Dane wg Położnictwo 2012, Bręborowicza tom II 2 str. 266:
- Infliksymab należy do kategorii B wg FDA. Przechodzi przez barierę łożyskową i jest wykrywalny w krwi płodowej. W badaniach na małych grupach pacjentów i ich potomstwie NIE stwierdzono powikłań ani u noworodków ani u matek przyjmujących lek do 30 tyg ciąży.
- Podawanie leku w III trymestrze wiązało się z wielomiesięcznym utrzymywaniem się leku w surowicy niemowląt, chociaż nie miało to wpływu na adekwatną odpowiedź immunologiczną na podawane szczepienia w 1 roku życia.
- Nie stwierdzono infliksymabu w mleku matki, a także w surowicy karmionego piersią noworodka co prawdopodobnie świadczy o bezpieczeństwie podawania tego leku w okresie karmienia piersią
Sposób podawania
[edytuj | edytuj kod]Infliksymab stosowany jest wyłącznie w postaci iniekcji dożylnych. Schematy dawkowania zależne są od jednostki chorobowej.
Preparaty
[edytuj | edytuj kod]Preparaty zawierające infliksymab dopuszczone do obrotu w Polsce (stan na wrzesień 2024): Flixabi, Inflectra, Remicade, Remsima, Zessly[18].
Przypisy
[edytuj | edytuj kod]- ↑ a b c S.P.L. Travis i inni, European evidence based consensus on the diagnosis and management of Crohn’s disease: current management, „Gut”, 55 (suppl 1), 2006, i16–i35, DOI: 10.1136/gut.2005.081950b, ISSN 0017-5749, PMID: 16481629, PMCID: PMC1859997 (ang.).
- ↑ a b Yoko Furuya i inni, Theory based analysis of anti-inflammatory effect of infliximab on Crohn's disease, „Drug Metabolism and Pharmacokinetics”, 22 (1), 2007, s. 20–25, DOI: 10.2133/dmpk.22.20, ISSN 1347-4367, PMID: 17329907.
- ↑ Informacja na stronie Puls Medycyny. [dostęp 2009-02-22]. [zarchiwizowane z tego adresu (2008-06-15)].
- ↑ E. William St. Clair i inni, Combination of infliximab and methotrexate therapy for early rheumatoid arthritis: A randomized, controlled trial, „Arthritis & Rheumatism”, 50 (11), 2004, s. 3432–3443, DOI: 10.1002/art.20568, ISSN 1529-0131, PMID: 15529377 (ang.).
- ↑ Ravinder Maini i inni, Infliximab (chimeric anti-tumour necrosis factor α monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomised phase III trial, „The Lancet”, 354 (9194), 1999, s. 1932–1939, DOI: 10.1016/s0140-6736(99)05246-0, ISSN 0140-6736, PMID: 10622295 (ang.).
- ↑ Information for the Arthritis Advisory Committee. REMICADE® (infliximab). Efficacy and Safety Review. 04 March 2003
- ↑ Paul Rutgeerts i inni, Infliximab for induction and maintenance therapy for ulcerative colitis, „The New England Journal of Medicine”, 353 (23), 2005, s. 2462–2476, DOI: 10.1056/NEJMoa050516, ISSN 1533-4406, PMID: 16339095.
- ↑ J. Braun i inni, International ASAS consensus statement for the use of anti-tumour necrosis factor agents in patients with ankylosing spondylitis, „Annals of the Rheumatic Diseases”, 62 (9), 2003, s. 817–824, DOI: 10.1136/ard.62.9.817, ISSN 0003-4967, PMID: 12922952, PMCID: PMC1754665.
- ↑ DD. Gladman, PJ. Mease. Towards international guidelines for the management of psoriatic arthritis.. „J Rheumatol”. 33 (7), s. 1228-30, Jul 2006. PMID: 16821263.
- ↑ Alice B Gottlieb, Infliximab for psoriasis, „Journal of the American Academy of Dermatology”, 49 (2, Suplement), 2003, s. 112–117, DOI: 10.1016/s0190-9622(03)01143-5, ISSN 0190-9622, PMID: 12894134 (ang.).
- ↑ Alice B. Gottlieb i inni, Infliximab monotherapy provides rapid and sustained benefit for plaque-type psoriasis, „Journal of the American Academy of Dermatology”, 48 (6), 2003, s. 829–835, DOI: 10.1067/mjd.2003.307, ISSN 0190-9622, PMID: 12789171.
- ↑ Alice B. Gottlieb i inni, Infliximab induction therapy for patients with severe plaque-type psoriasis: a randomized, double-blind, placebo-controlled trial, „Journal of the American Academy of Dermatology”, 51 (4), 2004, s. 534–542, DOI: 10.1016/j.jaad.2004.02.021, ISSN 1097-6787, PMID: 15389187.
- ↑ Shirish R. Sangle, Graham R.V. Hughes, David P. D'Cruz, Infliximab in patients with systemic vasculitis that is difficult to treat: poor outcome and significant adverse effects, „Annals of the Rheumatic Diseases”, 66 (4), 2007, s. 564–565, DOI: 10.1136/ard.2006.065623, ISSN 0003-4967, PMID: 17360788, PMCID: PMC1856044.
- ↑ P.P. Sfikakis, Behçet's disease: a new target for anti-tumour necrosis factor treatment, „Annals of the Rheumatic Diseases”, 61 Suppl 2, 2002, ii51–53, DOI: 10.1136/ard.61.suppl_2.ii51, ISSN 0003-4967, PMID: 12379622, PMCID: PMC1766720.
- ↑ a b c Jean-Frederic Colombel i inni, The safety profile of infliximab in patients with Crohn’s disease: The Mayo Clinic experience in 500 patients, „Gastroenterology”, 126 (1), 2004, s. 19–31, DOI: 10.1053/j.gastro.2003.10.047, ISSN 0016-5085, PMID: 14699483 (ang.).
- ↑ HJ. Bovenschen, M. Tjioe, H. Vermaat, D. de Hoop i inni. Induction of eruptive benign melanocytic naevi by immune suppressive agents, including biologicals.. „Br J Dermatol”. 154 (5), s. 880-4, May 2006. DOI: 10.1111/j.1365-2133.2006.07189.x. PMID: 16634890.
- ↑ Kane i wsp "Absence of infliximab in infants and brest milk..." J. Clin. Gastroenterol., 2009, 43: 613-616
- ↑ Infliximabum, [w:] Rejestr Produktów Lecznicznych, Ministerstwo Zdrowia [dostęp 2024-09-09], wynik wyszukiwania po nazwie powszechnie stosowanej.