Ozon
|
Opća svojstva | |||
|---|---|---|---|
| Naziv | ozon | ||
| Kemijska formula | O3 | ||
| Izgled | blijedoplavi plin | ||
| Molarna masa | 48,0 gram/mol | ||
| Talište | 81 K (-192 °C) | ||
| Vrelište | 161 K (-112 °C) | ||
| Gustoća | 2,144 kg m-3 (kod 0 °C) | ||
| Topljivost | 1,05 g dm-3 (kod 0 °C) | ||
| standardna entalpija formacije ΔfHº298; | 142,67 kJ mol-1 | ||
| standardna molarna entropija Sº298; | 238,92 J K−1 mol−1 | ||
|
Sigurnosne mjere | |||
| EU klasifikacija |   | ||
|
Gdje god je moguće korištene su jedinice SI | |||
| Dodaj infookvir "kemijski spoj". (Primjeri uporabe predloška) |
Ozon (O3) je alotrop kisika čija se molekula sastoji od 3 atoma kisika. Premda je količina ozona u atmosferi relativno mala (maksimalne koncentracije ne prelaze 0,001%), njegova važnost za život na Zemlji je ogromna.
Ozon je plin jakog mirisa (osjeti se u zraku već pri volumom udjelu od 0,0001%), blijedo plave boje.
U Zemljinoj je atmosferi smješten u stratosferi na visini od 20 do 50 km iznad površine Zemlje. Odgovoran je za upijanje nekih valnih duljina ultraljubičastog zračenja (UVC i UVB) koje dolazi od Sunca, a upravo zbog tog zračenja i nastaje od molekula kisika. Bez stratosferskog ozona život na Zemlji ne bi bio moguć.[1][2]
Za razliku od ozona u ozonskom omotaču, koji je neophodan za život na Zemlji, ozon pri tlu je nepoželjan. U manjim količinama iritira očnu sluznicu, grlo, nos i dišne puteve, dok je u većim koncentracijama akutno opasan po život. Ozon koji nastaje u nižim slojevima atmosfere ili troposferski ozon sastavni je dio gradskoga smoga. Troposferski je ozon u neposrednom dodiru sa živim organizmima. Lako reagira s drugim molekulama. Oštećuje gumu, plastične mase, površinsko tkivo biljaka i životinja, pa štetno djeluje na ljudsko zdravlje (dišne organe), biljne usjeve i šume.[3] Zbog sve većeg prometa, količina ozona u troposferi u stalnom je porastu.
Ozon je najjače oksidacijsko sredstvo poslije fluora i vrlo je otrovan. Služi za sterilizaciju vode, operacijskih, kino i sportskih dvorana te kazališta, zatim u farmaceutskoj, kozmetičkoj, tiskarskoj industriji te industriji papira, tekstila i umjetnih materijala.
Ozon kao kemijsku tvar prvi je prepoznao Christian Friedrich Schönbein 1840., koji ga je nazvao prema grčkoj riječi ozein, što bi značilo miris, prema svojstvenom mirisu, posebno nakon grmljavinskih oluja i munja. Kemijsku formulu za ozon O3 je odredio Jacques-Louis Soret 1867.[4][5]
Ozon je blijedo plavi plin, slabo topljiv u vodi, dok je u nepolarnim otapalima dobro topljiv, kao što su ugljikov tetraklorid (CCl4) ili florougljici, gdje stvara plavu otopinu. Pri temperaturi od -112°C tvori eksplozivno nestabilnu, tamno-plavu tekućinu, a pri temperaturama nižim od -193° tvori eksplozivno nestabilnu ljubičasto-crnu čvrstu tvar.[6]
Ozon je dijamagnetična tvar, za razliku od kisika koji je paramagnetičan.
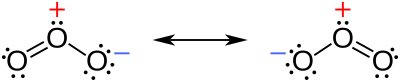
Zahvaljujući rezultatima rotacijske spektroskopije, znamo da ozon nije ravna molekula, već sliči molekuli vode. Razmak O – O veze je 127,2 pm. Kut O – O – O je 116,78°. Ozon je polarna molekula, s dipolnim momentum od 0,53 D (debye). To je molekula koja ima jednu jednostruku i jednu dvostruku vezu.[7][8]
Ozon je vrlo snažan oksidans, puno jači od kisika. Nestabilan je kod većih koncentracija, raspadajući se na kisik (s vremenom poluraspada od oko pola sata kod atmosferskih uvjeta):[9]
- 2 O3 → 3 O2
Taj se process ubrzava s povećanjem temperature i tlaka. Brzi raspad ozona može pobuditi iskra kod koncentracije od 10 % ili više.[10]
Ozon će oksidirati većinu metala (osim zlata, platine i iridija), primjerice bakar:
- 2 Cu+ + 2 H3O+ + O3 → 2 Cu2+ + 3 H2O + O2
Ozon će oksidirati dušikov oksid prvo u dušikov dioksid, što je reakcija koju prati kemoluminiscencija:
- NO + O3 → NO2 + O2
Dušikov dioksid dalje oksidira u dušikov trioksid:
- NO2 + O3 → NO3 + O2
Dušikov trioksid će dalje reagirati s ostatkom dušikovog dioksida u dušikov pentoksid:
Kruti dušikov dioksid perklorat se može dobiti iz dušikovog dioksida, klorovog dioksida i ozona:
- 2 NO2 + 2 ClO2 + 2 O3 → 2 NO2ClO4 + O2
Ozon ne reagira sa solima amonijaka, ali oksidira amonijak u amonijev nitrat:
- 2 NH3 + 4 O3 → NH4NO3 + 4 O2 + H2O
Ozon oksidira ugljik u ugljikov dioksid čak i na sobnoj temperaturi:
- C + 2 O3 → CO2 + 2 O2
Ozon oksidira sulfide u sulfate.
Olovov(II) sulfid oksidira u olovov(II) sulfat:
- PbS + 4 O3 → PbSO4 + 4 O2
Sumporna kiselina se može dobiti od ozona, vode i elemenata kao što je sumpor ili sumporov dioksid:
- S + H2O + O3 → H2SO4
- 3 SO2 + 3 H2O + O3 → 3 H2SO4
Plinoviti sumporovodik se oksidira u sumporov dioksid, a odmah zatim u sumporov trioksid:
- H2S + O3 → SO2 + H2O
- SO2 + O3 → SO3 + O2
S tekućim sumporovodikom, reagira u dvije istovremene reakcije:
- H2S + O3 → S + O2 + H2O
- 3 H2S + 4 O3 → 3 H2SO4
Kositrov(II) klorid u klorovodičnoj kiselini reagira s ozonom i daje kositrov(IV) klorid i vodu:
- 3 SnCl2 + 6 HCl + O3 → 3 SnCl4 + 3 H2O
Jodov perklorat se može dobiti otapanjem joda u hladnoj perkloratnoj kiselini i s ozonom:
- I2 + 6 HClO4 + O3 → 2 I(ClO4)3 + 3 H2O
Ozon se može koristiti za izgaranje, jer stvara više temperature od kisika. Ugljikovog subnitrid gori u ozonu i daje ugljikov monoksid i dušik:
- 3 C4N2 + 4 O3 → 12 CO + 3 N2
Ozon može reagirati kod vrlo niskih temperatura. Kod −196 °C atomski vodik reagira s tekućim ozonom, stvarajući radikalnu molekulu vodikov superoksid:[11]
- H + O3 → HO2 + O
- 2 HO2 → H2O4
Redukcijom ozona stvara se anion ozonid O3–. Derivati tih aniona su eksplozivni i moraju se čuvati na vrlo niskim temperaturama. Svi superoksidi alkalijskih metala oksidiraju u ozonide općom jednadžbom kemijske reakcije:
- MO2 + O3 → MO3 + O2
Iako kalijev ozonid se može dobiti na gornji način, moguće ga je dobiti iz kalijevog hidroksida i ozona:
- 2 KOH + 5 O3 → 2 KO3 + 5 O2 + H2O
Natrijev i litijev ozonid se pripremaju djelovanjem cezijevog ozonida u tekućem amonijaku na ionskom izmjenjivaču koj sadrži ione Na+ ili Li+:
- CsO3 + Na+ → Cs+ + NaO3
Otopina kalcija uamonijaku reagira s ozonom stvarajući amonijev ozonid, a ne kalcij ozonid:
- 3 Ca + 10 NH3 + 6 O3 → Ca·6NH3 + Ca(OH)2 + Ca(NO3)2 + 2 NH4O3 + 2 O2 + H2
Ozon se može koristiti za uklanjanje mangana iz vode, stvarajući talog koji se može ukloniti filtriranjem:
- 2 Mn2+ + 2 O3 + 4 H2O → 2 MnO(OH)2 (s) + 2 O2 + 4 H+
Slično, ozon se može iskoristiti za uklanjanje cijanida, pretvarajući ih u cijanate, koji su puno manje otrovni:
- CN- + O3 → CNO- + O2
Ozon može potpuno rastaviti ureu:[11]
- (NH2)2CO + O3 → N2 + CO2 + 2 H2O
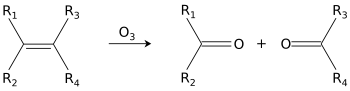
Ozon rastavlja alkene i daje ketone.



Dobsonova jedinica je jedinica u kojoj se najčešće izražava količina ozona u atmosferi. Količina ozona u atmosferi izražena u DU jednaka je ukupnoj količini ozona koja se nalazi u vertikalnom stupcu zraka koji se proteže od tla do vrha atmosfere. Kada bi sav ozon iz vertikalnog stupca doveli na standardne uvjete ne mijenjajući pri tom veličinu baze stupca, stupac ozona visok 0,01 mm bio bi jednak jednoj DU. Uobičajena količina ozona u atmosferi je 300 DU.
Najveća koncentracija ozona u atmosferi je u stratosferi i ona se naziva ozonski omotač, a to je između 10 do 50 km iznad Zemljine površine (stratosferski ozon). Premda je količina ozona u atmosferi relativno mala (maksimalne koncentracije ne prelaze 0,001 %), njegova važnost za život na Zemlji je ogromna. To je filter za Sunčevo ultraljubičasto zračenje valne duljine manje od 320 nm (UVB i UVC). Osim ozona ni jedan od preostalih sastojaka atmosfere ne apsorbira UV zračenje u rasponu od 240 do 290 nm. Kad bi to zračenje došlo do Zemljine površine, oštetilo bi genetički materijal (DNA), a fotosinteza, koja je neophodna za biljni svijet, bila bi onemogućena.
Ozon u stratosferi nastaje uglavnom djelovanjem ultraljubičastog zračenja sa Sunca, koje reagira s dvoatomnim kisikom O2:
- O2 + foton (UV zračenje < 240 nm) → 2 O
- O + O2 + M → O3 + M
Ozon se u istom ciklusu raspada reakcijom s jednoatomnim kisikom O:
- O3 + O → 2 O2
Zadnja reakcija se odvija uz prisustvo katalizatora, a to su prisutni slobodni radikali u atmosferi, od kojih su najvažniji hidroksil (OH), dušikov oksid (NO), atomski klor (Cl) i brom (Br). Sredinom sedamdesetih godina 20. stoljeća nad Antarktikom je u ozonskom omotaču uočeno veliko smanjenje koncentracije ozona (ozonske rupe) s obzirom na ranija razdoblja koje je uzrokovano ljudskim djelovanjem, odnosno ljudskom emisijom klorofluorougljika (CFC, koji su poznati i pod nazivom freoni). Najveće smanjenje (ponegdje čak do 99%) uočeno je na visinama od 14-19 km nad tlom. Kako bi spriječila pogubno djelovanje ozonske rupe na život na Zemlji, međunarodna zajednica ulaže velike napore da se emisija CFC svede na minimum.
U urbaniziranim sredinama ozon nastaje pri tlu fotokemijskim reakcijama bogatoj dušikovim oksidima NO i NO2 (koji se najčešće kraće označavaju s NOx), a koji su u atmosferu dospijevaju u većim količinama kao posljedica ljudskih aktivnosti (naročito prometa). Stoga se u velikim gradovima s gustim prometom, koji obiluju Sunčevim zračenjem, a nalaze se u toplim i suhim klimama (poput npr. Rima, Tokija, Atene i Los Angelesa), javlja onečišćenje zraka poznato pod nazivom fotokemijski smog. U tako onečišćenoj atmosferi uz O3 i NOx nalaze se i organski nitrati, poput PAN-a (peroksiacetil nitrat CH3C(O)OONO2), oksidirani ugljikovodici i tzv. fotokemijski aerosol, a nad gradom se zbog velike količine aerosola može vidjeti žućkasto-smeđi oblak, koji je zbog svog čestog pojavljivanja nad Atenom dobio ime nefos (od grčke riječi νεφοσ, što znači oblak).[12]
Trajanje troposferskog ozona je otprilike 22 dana. Uglavnom se na kraju taloži na tlo, u obliku hidroksilnih (OH) spojeva ili peroksilnih radikala (HO2). Postoje snažni dokazi da povećana koncentracija ozona na tlu dovodi do smanjenih prinosa u poljoprivredi, jer ozon utječe na procese fotosinteze i usporava cjelokupan rast biljaka.[13][14][15]
Ozon napada polimere, koji imaju olefinske i dvostruke veze u svojoj lančanoj strukturi, kao što su prirodne i umjetne gume. To izaziva pukotine na njima, koje s vremenom postaju duže i dublje. Rješenje je korištenje voska, koji stvara zaštitni sloj preko gume. Javlja se kod starih automobilskih guma, ali i brtva i O – prstena. Gumene cijevi za dovod goriva imaju često taj problem, posebno ako su u blizini električnih uređaja, kao što su istosmjerni elektromotori (kolektor stalno iskri, te stvara ozon).
Iako je ozon bio prisutan u blizini tla i prije industrijske revolucije, danas su mu troposferske koncentracije puno veće, što dodatno djeluje na efekt staklenika, upijajući dio dugovalnog infracrvenog zračenja s površine Zemlje. Ozon u troposferi nije jednoliko raspoređen, ali procjena Međuvladinog panela o klimatskim promjenama govori da iznosi oko 25 % od ukupnog dodatnog zračenja što ga ostvaruje ugljikov dioksid.[16][17][18]
Ozon je puno jači staklenički plin od ugljikovog dioksida, ali je u manjoj koncentraciji i ima puno kraće trajanje, zbog čega nema veliki utjecaj na globalno zatopljenje, ali u nekim područjima s velikom koncentracijom ima i 50 % veće dodatno zračenje od ugljikovog dioksida.[19]

Većina ljudi može osjetiti miris ozona već pri koncentraciji od 0.01 ppm (oko 0.02 mg m-3) u zraku, zbog vrlo oštrog mirisa, koji podsjeća na klorni izbjeljivač. Kod izloženosti od 0.2-0.5 ppm (oko 0.4 do oko 1 mg m-3) izaziva glavobolju, iritira očnu sluznicu, grlo, nos i dišne puteve. LD50 za ozon kod četverosatne izloženosti iznosi 9.9 ppm (oko 19.52 mg m-3).
Ozon izaziva velike poteškoće za one bolesnike s astmom, bronhitisom i sa srčanim smetnjama.[21]
Dugo izlaganje ozonu povećava rizik smrtnosti zbog bolesti dišnih puteva. Jedna studija u SAD, na 450 000 ljudi, pokazala je snažnu povezanost između razine ozona i bolesti dišnih puteva, u trajanju od 18 godina. Studija je zaključila da ljudi koji žive u gradovima, s visokim koncentracijama ozona, imaju 30 % povećani rizik smrtnosti od bolesti dišnih puteva.[22][23]
Prema Američkoj agenciji za zaštitu okoliša (engl. United States Environmental Protection Agency - EPA), ozon s koncentracijom 0,004 % ili više, može štetno djelovati na osjetljive ljude. U Europskoj uniji propisi (Directive 2008/50/EC) dozvoljavaju najveću koncentraciju ozona od 0,006 %, ali se još ne zna kada će stupiti na snagu. Svjetska zdravstvena organizacija preporučuje najveću koncentraciju ozona od 0,0051 %.[24][25]
Ozon, uz još druge oblike reaktivnog kisika, prirodno stvaraju u našem tijelu bijela krvna zrnca ili leukociti, da bi uništili strane mikroorganizme. Ozon reagira direktno s organskim spojevima koji imaju dvostruke veze. Smatra se čak da je ozon povezan i s upalnim procesima.[26]
Povećana razina ozona se može pojaviti u linijskim putničkim zrakoplovima, koji lete na velikim visinama i kod jačih turbulencija. Maksimalno dozvoljeni nivo ozona je 0,001 %, za trajanje leta od 4 sata. Neki zrakoplovi su opremljeni s uređajima u ventilaciji, koji smanjuju razinu ozona.[27][28]
Kod industrijskog dobivanja ozona, koncentracije koje se dobivaju su 1 do 5 % u zraku, a 6 do 14 % u kisiku, kod starijih metoda. Nove elektrolitičke metode ostvaruju 20 do 30 % otopljenog ozona u vodi.[29]
Temperatura i vlažnost zraka igraju veliku ulogu kod dobivanja ozona koronalnim pražnjenjem i s UV zračenjem, te produktivnost može biti i 50 % manja kod vlažnog zraka. Nove metode koriste elektrolitičke metode za dobivanje ozona iz molekula vode.
To je najčešći način stvaranja ozona u industriji i u domaćinstvima. Koristi se zrak, relativno je jeftinija metoda i može se dobiti 3 do 6 % ozona. Popratna pojava kod korištenja vlažnog zraka je stvaranje dušikovih oksida.[30]
To je jeftinija metoda dobivanja ozona, ali je sporija i daje najviše 0,5 % ozona, tako da je za neke primjene nepraktična. Koristi se za pročišćavanje vode u bazenima i termalnim kupalištima. Prednost je što se ne stvaraju dušikovi oksidi, dobro radi u vlažnom zraku i ne treba sušenje zraka.[31]
Hladnu plazmu se dobiva dielektričnim pražnjenjem u kisiku. Dvoatomni kisik se razdvaja u jednoatomni, koji se ponovo spaja u ozon. Najviša dobivena volumna koncentracija je 5 %. Prednost je lako dobivanje velikih količina, a nedostatak su visoki investicijski troškovi pa se metoda rjeđe koristi.
Elektrolizom vode u vrlo kiselom mediju i velikom jakosti struje dobivaju se vodik, kisik i ozon. Ovom metodom se može dobiti 20 do 30 % otopljenog ozona u vodi, a prednost je što ne ovisi o zraku.
- 3 H2O → O3 + 6 H+ + 6 e− (ΔEo = −1.53 V)
- 6 H+ + 6 e− → 3 H2 (ΔEo = 0 V)
- 2 H2O → O2 + 4 H+ + 4 e− (ΔEo = −1.23 V)
Ozon se ne može staviti u spremnik i zatim transportirati kao ostali tehnički plinovi, jer se brzo raspada u kisik. Zato se mora stvarati na mjestu upotrebe.
Zbog visoke reaktivnosti, uređaji za dobivanje ozona proizvode se od samo nekoliko materijala: nehrđajući čelik (SS 316L), titanij, aluminij (ako nema vlage), staklo, teflon (PTFE) ili PVDF. Za brtve treba koristiti silikonske gume.
Ozon se može stvoriti u zraku električnim pražnjenjem kod visokih napona i jakosti struje. Električni uređaji koji stvaraju znatnu količinu ozona su ionski pročiščivač zraka, laserski pisač, fotokopirni uređaji, uređaj za elektrolučno zavarivanje. Istosmjerni elektromotori koji imaju četkice stvaraju ozon iskrenjem na kolektoru.
Postoji pojava na rijeci Catatumbo u Venezueli, kod nastajanja grmljavinskih oluja, kada nastaju velike količine ozona, koje odlaze u gornje slojeve troposfere. To je svjetski najveći generator ozona i proglašen je UNESCO-ovom Svjetskom baštinom.[32]
Ozon se industrijski koristi za:
- dezinfekciju u bolnicama
- dezinfekciju kod proizvodnje hrane u prehrambenoj industriji
- dezinfekciju vode umjesto klora
- proizvodnju lijekova
- dobivanju sintetskih motornih ulja
- pročišćavanje zraka u objektima nakon požara
- higijenu bazena i termalnih kupališta
- uništavanje insekata kod uskladištenih žitarica
- uništavanje plijesni i kvasaca u proizvodnji hrane
- uništavanje plijesni, kvasaca i bakterija kod svježeg voća i povrća
- uklanjanje zagađivača kod tretiranja otpadnih voda (spojevi željeza, arsena, sumporovodik, nitriti, nitrati itd.)
- čišćenje i izbjeljivanje tkanina
- izbjeljivanje papira
Upotreba ozona u domaćinstvu je ograničena na male ozonizatore te je vrlo rizična zbog otrovnosti ozona.[33]
- ↑ "Ozone - Good Up High Bad Nearby" [1]
- ↑ "Ground-level Ozone" [2]
- ↑ Theodore L. Brown, H. Eugene LeMay Jr., Bruce E. Bursten, Julia R. Burdge: "Chemistry: The Central Science", 2003.,publisher = Pearson Education
- ↑ Rubin Mordecai B.: "The History of Ozone. The Schönbein Period, 1839–1868", journal=Bull. Hist. Chem., [3], 2001.
- ↑ [4] "Today in Science History", 2006.
- ↑ "Oxygen" [5] Arhivirana inačica izvorne stranice od 14. veljače 2008. (Wayback Machine) 2006.
- ↑ Tanaka Takehiko, Morino Yonezo: "Coriolis interaction and anharmonic potential function of ozone from the microwave spectra in the excited vibrational states", journal = Journal of Molecular Spectroscopy, 1970.
- ↑ Mack Kenneth M., Muenter J. S.: "Stark and Zeeman properties of ozone from molecular beam spectroscopy", journal = Journal of Chemical Physics, 1977.
- ↑ [6] Arhivirana inačica izvorne stranice od 1. lipnja 2006. (Wayback Machine) "Earth Science FAQ: Where can I find information about the ozone hole and ozone depletion?" Goddard Space Flight Center, National Aeronautics and Space Administration, 2008.
- ↑ [url=http://www.iitk.ac.in/che/jpg/papersb/full%20papers/K-106.pdf%7Cdoi=10.1016/j.jlp.2005.07.020[neaktivna poveznica]] "Explosion properties of highly concentrated ozone gas", 2005., Koike K., Nifuku M., Izumi K., Nakamura S., Fujiwara S., Horiguchi S., journal=Journal of Loss Prevention in the Process Industries
- ↑ a b "Ozone" Horvath M., Bilitzky L., Huttner J., 1985.
- ↑ WHO-Europe reports: [7] Arhivirana inačica izvorne stranice od 9. svibnja 2003. (Wayback Machine) "Health Aspects of Air Pollution", 2003.
- ↑ Stevenson: [8] Arhivirana inačica izvorne stranice od 4. studenoga 2011. (Wayback Machine) "Multimodel ensemble simulations of present-day and near-future tropospheric ozone", publisher=American Geophysical Union, 2006.
- ↑ [9] "Rising Ozone Levels Pose Challenge to U.S. Soybean Production, Scientists Say", publisher=NASA Earth Observatory, 2006.
- ↑ Mutters Randall [10] Arhivirana inačica izvorne stranice od 17. veljače 2004. (Wayback Machine) "Statewide Potential Crop Yield Losses From Ozone Exposure", publisher=California Air Resources Board, 2006.
- ↑ [11] Arhivirana inačica izvorne stranice od 24. kolovoza 2006. (Wayback Machine) "Tropospheric Ozone in EU - The consolidated report", publisher=European Environmental Agency, 2006.
- ↑ "Atmospheric Chemistry and Greenhouse Gases", [12] Arhivirana inačica izvorne stranice od 10. srpnja 2006. (Wayback Machine) publisher=Intergovernmental Panel on Climate Change, 2006.
- ↑ title=Climate Change 2001 Arhivirana inačica izvorne stranice od 27. rujna 2006. (Wayback Machine) publisher=Intergovernmental Panel on Climate Change, 2006.
- ↑ "Life Cycle Assessment Methodology Sufficient to Support Public Declarations and Claims, Committee Draft Standard, Version 2.1. Scientific Certification Systems", 2011.
- ↑ [13] "Watching Our Ozone Weather", 2003., Jeannie Allen, publisher=NASA Earth Observatory
- ↑ [14] "Answer to follow-up questions from CAFE", 2004.
- ↑ Jerrett Michael, Burnett Richard T. and Pope C. Arden, III and Ito, Kazuhiko and Thurston, George and Krewski, Daniel and Shi, Yuanli and Calle, Eugenia and Thun, Michael, journal = N. Engl. J. Med., 2009., "Long-Term Ozone Exposure and Mortality" = 10.1056/NEJMoa0803894|pmid = 19279340
- ↑ Wilson Elizabeth K.: "Ozone's Health Impact", 2009., journal = Chemical & Engineering News, publisher = American Chemical Society Publications [15]
- ↑ Weinhold B.: "Ozone nation: EPA standard panned by the people", journal=Environ. Health Perspect., 2008.
- ↑ [16] Arhivirana inačica izvorne stranice od 6. srpnja 2010. (Wayback Machine) publisher=EC, 2010., "DIRECTIVE 2008/50/EC on ambient air quality and cleaner air for Europe"
- ↑ "The Story of O" Roald Hoffmann, journal=American Scientist, 2004., doi=10.1511/2004.1.23 [17] 2006.
- ↑ [18]airplane-air-heavy-on-the-ozone
- ↑ [19] Sciencedaily.com
- ↑ Brown Theodore L., H. Eugene LeMay Jr., Bruce E. Bursten, Julia R. Burdge: "Chemistry: The Central Science", 2003., publisher = Pearson Education
- ↑ "Organic Syntheses", Coll. Vol. 3, p.673, 1955. Article
- ↑ Dohan J. M., W. J. Masschelein, journal=Ozone Sci. Eng., "Photochemical Generation of Ozone: Present State-of-the-Art"
- ↑ "Fire in the Sky" [20] Arhivirana inačica izvorne stranice od 21. srpnja 2011. (Wayback Machine), 2008.
- ↑ [21] "EPA report on consumer ozone air purifiers"