Hydroxyde de lithium
| Hydroxyde de lithium | |
| |
| Identification | |
|---|---|
| Nom UICPA | Hydroxyde de lithium |
| Synonymes |
lithine, hydroxyde de lithine, lithine aqueuse |
| No CAS | (anhydre) (monohydrate) |
| No ECHA | 100.013.804 |
| No CE | 215-183-4 |
| SMILES | |
| InChI | |
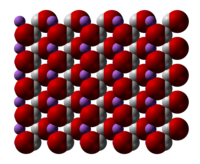
| Apparence | cristaux incolores, hygroscopiques. (monohydrate)[1] |
| Propriétés chimiques | |
| Formule | LiOH |
| Masse molaire[3] | 23,948 ± 0,002 g/mol H 4,21 %, Li 28,98 %, O 66,81 %, |
| pKb | -2,36 |
| Moment dipolaire | 4,754 ± 0,002 D [2] |
| Propriétés physiques | |
| T° fusion | 450 à 471 °C (monohydrate)[1] |
| T° ébullition | (décomposition) : 924 °C (monohydrate)[1] |
| Solubilité | dans l'eau à 20 °C : 109 g·l-1 (monohydrate)[1], 128 g·l-1 (20 °C,eau) |
| Masse volumique | anhydre 2,54 solide, monohydrate 1,51 |
| Thermochimie | |
| S0solide | 42,81 J.K-1.mol-1 |
| ΔfH0solide | -484,93 kJ/mol |
| ΔvapH° | 188 kJ·mol-1 (1 atm, 1 626 °C)[4] |
| Précautions | |
| SIMDUT[5] | |
 E, |
|
| Transport | |
| Composés apparentés | |
| Autres cations | Hydroxyde de sodium Hydroxyde de potassium Hydroxyde de césium Hydroxyde de rubidium |
| Autres anions | Oxyde de lithium |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L’hydroxyde de lithium (LiOH, CAS : 1310-65-2), aussi appelé lithine, est une base corrosive, produite par exemple lors du mélange réactif entre le lithium métal solide et l'eau :
Cet alcali sous forme de cristaux incolores, très caustique, est analogue à la soude (NaOH) et la potasse (KOH), bien que certaines de ses propriétés soient uniques. Son principal avantage par rapport à celles-ci concerne sa faible masse molaire et sa plus grande densité, ce qui rend ses utilisations en milieu confiné plus pratiques[6]. On peut ajouter, à cette compacité et légèreté, la grande puissance du couple redox Li+/Li, en particulier son potentiel d'oxydoréduction et sa durabilité.
Propriétés
[modifier | modifier le code]L'hydroxyde de lithium se présente sous la forme d'un cristal blanc hygroscopique[7]. Il est soluble dans l'eau (128 g·l-1 à 20 °C), et faiblement dans l'éthanol. Il fond à 471 °C.
Utilisations
[modifier | modifier le code]La lithine caustique a été une base forte employée en savonnerie. Elle permet d'obtenir des savons gras de lithium, par exemple des stéarate de lithium, par réaction de saponification. Ces savons servent à fabriquer des lubrifiants et anti-adhésifs de fonderie.
L'hydroxyde de lithium sert à fabriquer des sels ou polymères techniques principalement à propriétés anti-statiques.
D'autres utilisations le font intervenir dans les synthèses de polymères ou comme électrolyte dans les piles, puissantes et à usage fiable de longue durée, mais aussi dans les accumulateurs au lithium.
Purification de l'air par absorption du CO2
[modifier | modifier le code]L'hydroxyde de lithium est utilisé à partir des années cinquante lors des missions spatiales[8] et dans les sous-marins pour purifier l'air[9]. En effet, l'hydroxyde de lithium réagit avec le dioxyde de carbone suivant la réaction acido-basique suivante :
Réacteurs nucléaires
[modifier | modifier le code]La lithine est également utilisée dans les réacteurs nucléaires à eau, notamment ceux mettant en œuvre l'acide borique dissous. La lithine vient y contrer l'acidité du circuit primaire générée par l'acide borique (lui-même injecté comme neutrophage). Le choix s'est porté sur lui car une faible partie du bore 10 se transforme en lithium 7 par réaction (n + B10 → alpha + Li7) (environ 2 %).
La lithine utilisée dans les réacteurs nucléaires est à base de lithium enrichi en Li7 ; ainsi l'absence de Li6 prévient la formation de tritium (indésiré) par réaction (n + Li6 → T + alpha).
Histoire
[modifier | modifier le code]Le nom lithine est mentionné en 1827 dans le dictionnaire de l'académie. Il désigne le plus souvent l'alcali caustique LiOH, mais parfois encore l'(hémi)oxyde de lithium. Autrefois, il désignait plus souvent le carbonate de lithium.
Toxicité
[modifier | modifier le code]C'est un alcali très caustique, pour les muqueuses et la peau.
Notes et références
[modifier | modifier le code]- HYDROXYDE DE LITHIUM, MONOHYDRATE, Fiches internationales de sécurité chimique
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- « Hydroxyde de lithium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Ainsi les sous-marins, les avions, les capsules spatiales...
- "Lithium et composés minéraux", INRS, Fiche toxicologique n°158
- Par une manipulation in extremis, l'équipage de la mission Apollo 13 survécut en exploitant cette réaction.
- L'équipement sous-marin est le plus ancien, avant l'emploi commun de piles dans les années 1980 ou la mise au point d'accumulateurs dans les décennies suivantes.



